2016江苏小高考化学
编辑: 成考报名 发布时间:09-21 阅读:
2016江苏小高考化学(一)
2016江苏省高考化学考试试卷
2016江苏省高考化学
考试试卷
可能用到的相对原子质量:C-12 N-14 O-16 Mg-24 Si-28 S-32 Cl-35.5 Ca-40
选择题(共40分)
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
1.国务院颁布的《“十二五”控制温室气体排放工作方案》提出,2015年我国单位国内生产总值CO2排放要比2010年下降17%。下列说法不正确的是
A.CO2属于酸性氧化物 B.CO2是导致酸雨发生的主要原因
C.可用Na2CO3溶液捕捉(吸收)CO2 D.使用氢能源替代化石燃料可减少CO2排放
2.下列有关化学用语表示正确的是
A.过氧化钙(CaO2)的电子式:
B.8O离子的结构示意图:
+162- 2- C.H2CO3的电离方程式:H2CO3 2H+CO3
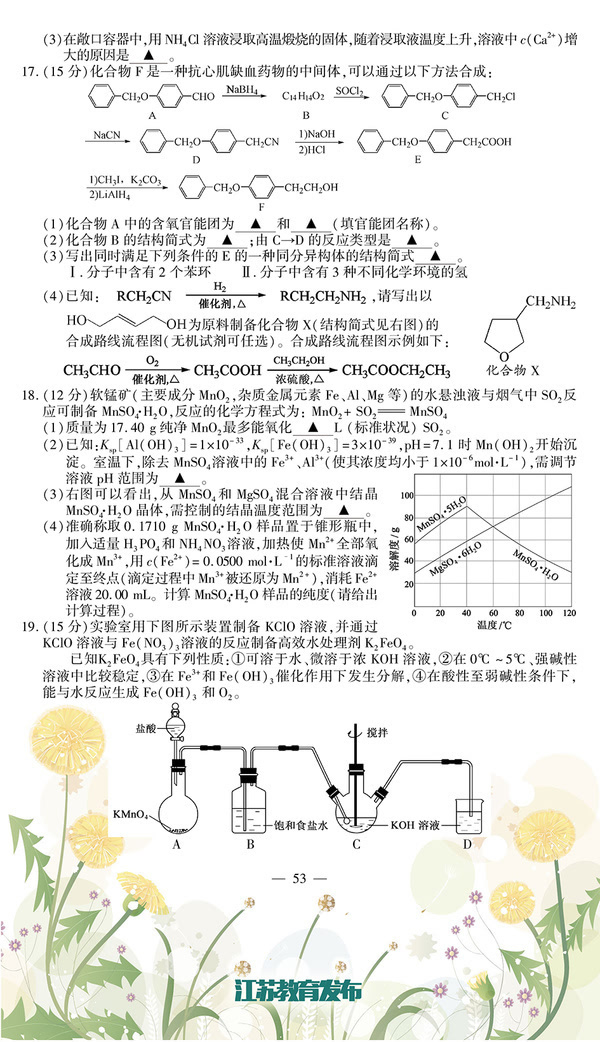
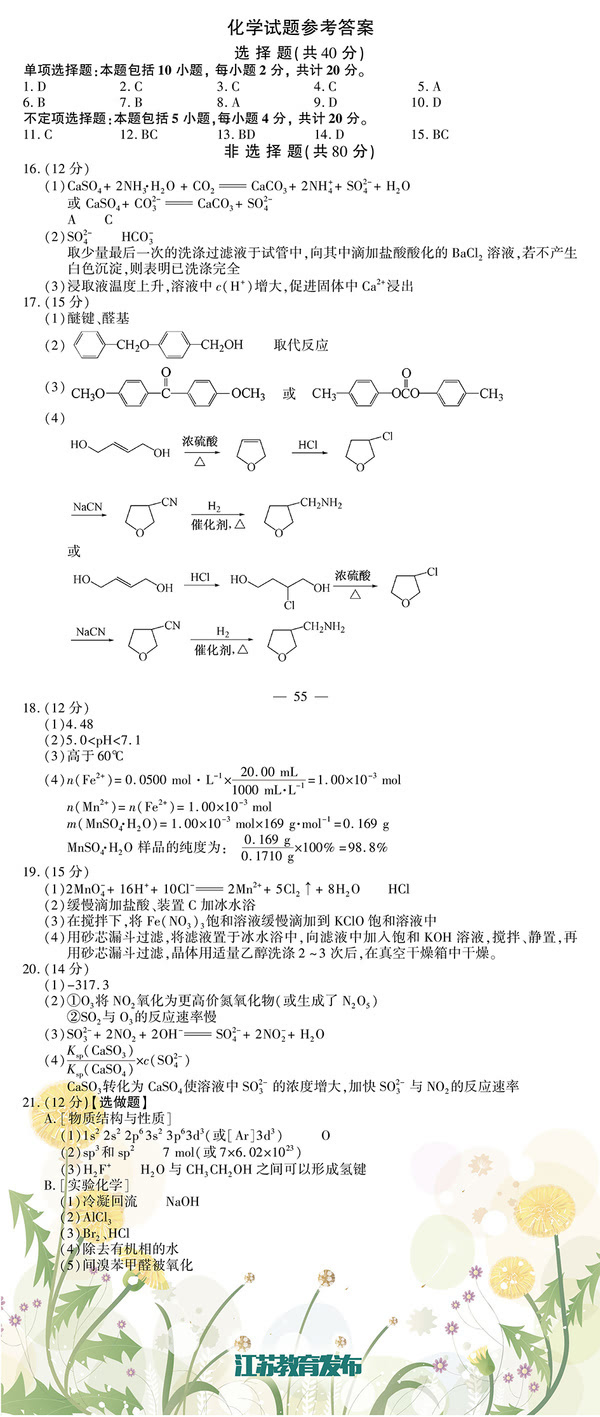
D.葡萄糖的结构简式:C6H12O6
3.常温下,下列各组离子在指定溶液中一定能大量共存的是
3+2- -- A.滴加石蕊试液显红色的溶液:Fe 、SO4、C1 、SCN
3++2- B.c(Al )=0.5mol·L 的溶液中:Na、K+、HCO3-、SO4
-+2-+-+ C.c(OH )/c(H)=10 的溶液中:SO3、NH4、NO3、K
+2+3+- D.滴加甲基橙试液呈红色的溶液:NH4、Ba 、Al 、Cl
4.下列物质性质与应用对应关系正确的是
A.硫酸铜溶于水呈酸性,可用来做杀菌剂
B.氨气具有还原性,可用于检查HCl泄漏
C.MgO、Al2O3熔点高,可用于制作耐高温坩埚
D.FeCl3溶液显酸性,可用于蚀刻印刷电路板
5.用下列实验装置进行相应实验,能达到实验目的的是
A.用图1装置作为制取少量二氧化硫的尾气吸收装置
B.用图2装置进行二氧化碳喷泉实验
C.用图3装置进行二氧化锰和浓盐酸制取氯气的实验
D.用图4装置进行石油的分馏实验
6.设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2.24LCl2溶于足量水中转移电子的数目为0.1NA
B.标准状况下,22.4L苯中含有双键的数目为3NA
C.常温下,16gO2和O3的混合气体中含有氧原子的数目为NA
+ D.25℃时,pH=1的醋酸溶液中含有H的数目为0.1NA
7.下列表示对应化学反应或过程的离子方程式正确的是
+2+ A.铜片插入硝酸银溶液中:Cu+Ag =Cu +Ag
2+-2-B.碳酸氢钙与过量的NaOH溶液反应:Ca+2HCO3+2OH-=CaCO3↓+2H2O+CO3
+- C.用稀硝酸除去试管内壁银:Ag+2H+NO3=Ag++NO2↑+H2O
+2- D.向氨水中通入过量SO2:SO2+2NH3•H2O=2NH4+SO3+H2O
8.已知甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下:
下列说法不正确的
A.若A为硝酸,X为金属元素,则甲与丙反应可生成乙
B.若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质
C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀
D.若乙为NaHCO3,则丙一定是CO2
9.下列依据相关实验得出的结论正确的是
A.向硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中有气泡产 生,说明Ksp(BaCO3)<Ksp(BaSO4)
B.向淀粉溶液中加入稀硫酸并加热片刻,然后再加入适量银氨溶液进行水浴加热,没有 银镜生成,说明淀粉没有水解
C.将二氧化硫气体通入到高锰酸钾酸性溶液中,溶液紫红色褪去,说明二氧化硫有漂白性
D.向碳酸钠溶液中滴加几滴酚酞试液,然后再加入氯化钡溶液,溶液红色褪去,说明碳 酸钠溶液中存在水解平衡
10.短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径比Y的小,X与W同主族,Y、Z族序数之和为11,Z原子最外层电子数是内层电子总数的3倍。下列说法不.正确的是
A.元素Z、W的简单离子的电子层结构相同
B.元素Y的简单气态氢化物的热稳定性比Z的弱
C.W、Z两种元素形成的化合物中肯定不含共价键
D.由X、Y、Z三种元素形成的化合物,其水溶液可能显碱性
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一.个.或.两.个.选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项时,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11.下列说法正确的是
A.NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强
B.铁片镀锌时,铁片与外电源的正极相连
C.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,则ΔH<0
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g) NO(g)+SO3(g),
通入少量O2, 的值及SO2转化率不变
12. 咖啡和茶叶中富含漂木酸,它具有抗癌作用,其结构简式如下图。下列有关说法正确的是
A.每个分子中含有4个手性碳原子
B.能与FeCl3溶液发生显色反应
C.1mol该有机物只能与1molBr2发生反应
D.1mol该有机物最多与8molNaOH反应
13.某模拟“人工树叶”电化学实验装置如右图所示,该装置
能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正
确的是
A.该装置将化学能转化为光能和电能
+ B.该装置工作时,H从b极区向a极区迁移+
C.每生成1molO2,有44gCO2被还原
+- D.a电极的反应为:3CO2+18H-18e =C3H8O+5H2O
14.常温下,用 0.1mol·L HCl溶液滴定10.0mL浓度为
0.1mol·L−1NaCO 溶液,所得滴定曲线如右图所示。
下列说法正确的是
+-- A.当V=0时:c(H)+c(H2CO3)+c(HCO3)=c(OH)
+2-- B.当V=5时:c(Na )>c(HCO3)>c(CO3 )>c(Cl )
+-+- C.当V=a时:c(Na )>c(Cl )>c(H )=c(OH )
+-2- D.当V=10时:c(H )+c(H2CO3)=c(OH )+c(CO3)
15.向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一
定量的SO2和O2发生反应:2SO2(g)+O2(g) 2SO3(g) △H=-
197.74kJ·mol-1。其中甲充入2molSO2、1molO2,乙充入1molSO2、0.5molO2,一段时间后达到平衡时,测得两容器中c(SO2)[mol·L-1]随时间t(min)的变化关系如下图所示。下列说法正确的是
A.压强:p(甲)<2p(乙)
B.热量:Q(甲)<2Q(乙)
-1-1 C.乙中前5min内的反应速率v(O2)=0.10mol·L·min
D.保持其他条件不变,若起始时向乙中充入0.4mol
SO2、0.2molO2、0.4molSO3,则此时v(正)<v(逆)
非选择题(共80分)
16.(12分)草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下
:
已知:①Ksp(CaF2)=1.46×10,Ksp(CaCO3)=2.34×10。
②相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为
1.0mol·L-1计算)。
−10−9
(1) “粉碎”的目的是 ▲ 。
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化 如右下图。“酸浸”的适宜温度与时间分别为 ▲
(填字母)。
a.30℃、30min b.90℃、150min
c.70℃、120min d.90℃、120min
(3)将“沉镍”工序得到的混合物过滤,所得固体用
75%乙醇溶液洗涤、110 ℃下烘干,得草酸镍晶体。
用75%乙醇溶液洗涤的目的是 ▲ 。
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为
▲ 。第2步中加入适量NH4F溶液的作用是 ▲ 。
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该 制备过程的化学方程式 ▲ 。
17.(15分)酒石酸托特罗定主要用于由膀胱过动症引起的尿频、尿急和急迫性尿失禁等症
状。工业合成该药物的中间体(F)的路线如下:【2016江苏小高考化学】
回答下列问题:
(1)D分子中的含氧官能团名称为 ▲ ;
B→C包含两步反应,反应类型分别为 ▲ 、 ▲ 。
(2)A的结构简式为 ▲ 。
(3)写出苯甲醛与银氨溶液反应的化学方程式 ▲ 。
(4)B的一种同分异构体满足下列条件:
①能使溴的CCl4溶液褪色;
②能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。
写出该同分异构体的结构简式 ▲ 。(任写一种)
(5)已知呋喃丙胺(CH=CHCON(CH3)2 )是一种高效麻醉剂,写出以
、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机 试剂自选)。合成路线流程图示例如下:
▲ 。
18.(12分)矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示。
(1)CaxMgySi8O22(OH)m改写成氧化物的形式为 ▲ 。
(2)化学式中x、y、m的代数关系式为 ▲ 。
(3)为确定CaxMgySi8O22(OH)m的组成,进行如下实验:
①准确称取8.10g样品粉末,加入足量稀盐酸充分溶解,
过滤,将沉淀灼烧得固体4.80g。
②另准确称取16.20克样品粉末在空气中灼烧,样品减少的质量随
灼烧时间的变化如图所示。根据以上实验数据计算样品的化学式(写出计算过程)。 ▲
19.(15分)磺酰氯(SO2Cl2)用于有机合成、医药、染料、农药等,也用作表面活性剂,熔点—54.1℃,沸点69.1℃,遇水发生剧烈水解。某学习小组用如下装置制备磺酰氯。(已知:SO2(g)+Cl2(g) SO2Cl2(l) △H<0)
(1)若用浓盐酸与二氧化锰为原料制取Cl2,
反应的化学方程式为 ▲ 。
(2)仪器B的作用是 ▲ 。烧杯中
盛放的溶液为 ▲ 。
(3)检验装置气密性的方法为 ▲ 。向装
置A中通入SO2 和Cl2 后很快有液态物质
生成。制备过程中需采用冰水浴,从化学
反应原理角度分析可能原因为 ▲ 。
(4)向分离提纯后的SO2Cl2中加水,出现白雾,振荡、
静置得到无色溶液W。经分析 SO2Cl2 与H2O反应属于非氧化
-还原反应,无色溶液W中的阴离子除含少量OH外,还含有其它两种阴离子,请设计方案检验
溶液W中这两种阴离子 ▲ 。
20.(14分)二氧化硫的转化是资源利用和环境保护的重要研究课题。将二氧化硫进行转化 利用有多种方法。
−1 (1)已知2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ·mol
−1CaCO3(s)=CaO(s)+CO2(g) △H=+178.5kJ·mol
−1CaSO4(s)=CaO(s)+SO3(g) △H=+401.9kJ·mol
则“钙基固硫”的热化学方程式为:
2CaCO(s)+2SO(g)+O(g)=2CaSO(s)+2CO(g) △H= ▲ kJ·mol−1
++2+2+(2)可利用海水对含SO 的烟气进行脱硫,已知海水呈弱碱性,主要含有Na、K、Ca、Mg
-2--、Cl、SO4 、Br、HCO-3等离子。其工艺流程如下图所示:
2016江苏小高考化学(二)
2016江苏小高考化学试卷(图片版)


2016江苏小高考化学(三)
2016江苏小高考化学冲A必备和选择1200题
2016江苏小高考化学冲A必备和选择1200题
1、化合价(常见元素的化合价):
碱金属元素、Ag、H:+1 F:—1
Ca、Mg、Ba、Zn:+2 Cl:—1,+1,+5,+7 Cu:+1,+2 O:—2
Fe:+2,+3 S:—2,+4,+6 Al:+3 P:—3,+3,+5
Mn:+2,+4,+6,+7 N:—3,+2,+4,+5 2、氧化还原反应
定义:有电子转移(或者化合价升降)的反应 本质:电子转移(包括电子的得失和偏移) 特征:化合价的升降
氧化剂(具有氧化性)——得电子——化合价下降——被还原——还原产物 还原剂(具有还原性)——失电子——化合价上升——被氧化——氧化产物 口诀:得——降——(被)还原——氧化剂 失——升——(被)氧化——还原剂 四种基本反应类型和氧化还原反应关系: 氧化还原反应
分解
复分解
置换
3、金属活动性顺序表
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
还 原 性 逐 渐 减 弱
4、离子反应
定义:有离子参加的反应
电解质:在水溶液中或熔融状态下能导电的化合物
非电解质:在水溶液中和熔融状态下都不能导电的化合物 离子方程式的书写:
第一步:写。写出化学方程式
第二步:拆。易溶于水、易电离的物质拆成离子形式;难溶(如CaCO3、BaCO3、BaSO4、AgCl、
AgBr、AgI、Mg(OH)2、Al(OH)3、Fe(OH)2、Fe(OH)3、Cu(OH)2等),难电离(H2CO3、H2S、CH3COOH、HClO、H2SO3、NH3·H2O、H2O等),气体(CO2、SO2、NH3、Cl2、O2、H2等),氧化物(Na2O、MgO、Al2O3等)不拆
第三步:删。删去前后都有的离子
第四步:查。检查前后原子个数,电荷是否守恒 离子共存问题判断:
和-,Fe和-);
①是否产生沉淀(如:Ba2+SO422+OH
②是否生成弱电解质(如:NH
-) +和OH-,H+和CH
43COO
③是否生成气体(如:H+和CO
2-,H+和SO2-) 33
④是否发生氧化还原反应(如:H+、NO-和Fe2+/I-,Fe3+和I-)
3
5、放热反应和吸热反应
化学反应一定伴随着能量变化。
放热反应:反应物总能量大于生成物总能量的反应
常见的放热反应:燃烧,酸碱中和,活泼金属与酸发生的置换反应 吸热反应:反应物总能量小于生成物总能量的反应 常见的吸热反应:Ba(OH)2·8H2O和NH4Cl的反应,灼热的碳和二氧化碳的反应 C、CO、H2还原CuO 6、各物理量之间的转化公式和推论
⑴微粒数目和物质的量:n==N / NA,N==nNA NA——阿伏加德罗常数。规定0.012kg12C所含的碳原子数目为一摩尔,约为6.02×1023个,该数目称为阿伏加德罗常数 ⑵物质的量和质量:n==m / M,m==nM ⑶对于气体,有如下重要公式
a、气体摩尔体积和物质的量:n==V / Vm,V==nVm 标准状况下:Vm=22.4L/mol
b、阿伏加德罗定律:同温同压下V(A) / V(B) == n(A) / n(B) == N(A) / N(B) c、气体密度公式:ρ==M / Vm,ρ1/ρ2==M1 / M2 ⑷物质的量浓度与物质的量关系
(对于溶液)a、物质的量浓度与物质的量 C==n / V,n==CV
b、物质的量浓度与质量分数 C==(1000ρω) / M
7、配置一定物质的量浓度的溶液
①计算:固体的质量或稀溶液的体积
②称量:天平称量固体,量筒或滴定管量取液体(准确量取) ③溶解:在烧杯中用玻璃棒搅拌 ④检漏:检验容量瓶是否漏水(两次)
⑤移液:冷却到室温,用玻璃棒将烧杯中的溶液转移至选定容积的容量瓶中 ⑥洗涤:将烧杯、玻璃棒洗涤2—3次,将洗液全部转移至容量瓶中(少量多次)
⑦定容:加水至叶面接近容量瓶刻度线1cm—2cm处时,改用胶头滴管加蒸馏水至溶液的凹液面最低
点刚好与刻度线相切
⑧摇匀:反复上下颠倒,摇匀,使得容量瓶中溶液浓度均匀 ⑨装瓶、贴标签
必须仪器:天平(称固体质量),量筒或滴定管(量液体体积),烧杯,玻璃棒,容量瓶(规格),胶头滴管
9、钠的氧化物比较
11、金属的通性:导电、导热性,具有金属光泽,延展性,一般情况下除Hg外都是固态
12、金属冶炼的一般原理:
①热分解法:适用于不活泼金属,如Hg、Ag
②热还原法:适用于较活泼金属,如Fe、Sn、Pb等
③电解法:适用于活泼金属,如K、Na、Al等(K、Ca、Na、Mg都是电解氯化物,Al是电解Al2O3) 13、铝及其化合物 Ⅰ、铝
①物理性质:银白色,较软的固体,导电、导热,延展性
-②化学性质:Al—3e==Al3+
点燃 点燃 △
a、与非金属:4Al+3O2==2Al2O3,2Al+3S==Al2S3,2Al+3Cl2==2AlCl3 b、与酸:2Al+6HCl==2AlCl3+3H2↑,2Al+3H2SO4==Al2(SO4)3+3H2↑
常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸
-- c、与强碱:2Al+2NaOH+2H2O==2NaAlO2(偏铝酸钠)+3H2↑ (2Al+2OH+2H2O==2AlO2+3H2↑) 大多数金属不与碱反应,但铝却可以
高温
d、铝热反应:2Al+Fe2O3===2Fe+Al2O3,铝具有较强的还原性,可以还原一些金属氧化物 Ⅱ、铝的化合物
①Al2O3(典型的两性氧化物)
-- a、与酸:Al2O3+6H+==2Al3++3H2O b、与碱:Al2O3+2OH==2AlO2+H2O
②Al(OH)3(典型的两性氢氧化物):白色不溶于水的胶状物质,具有吸附作用 a、实验室制备:AlCl3+3NH3·H2O==Al(OH)3↓+3NH4Cl,Al3++3NH3·H2O==Al(OH)3↓+3NH4+ b、与酸、碱反应:与酸 Al(OH)3+3H+==Al3++3H2O
-- 与碱 Al(OH)3+OH==AlO2+2H2O ③KAl(SO4)2(硫酸铝钾) KAl(SO4)2·12H2O,十二水和硫酸铝钾,俗名:明矾
- KAl(SO4)2==K++Al3++2SO42,Al3+会水解:Al3++3H2O Al(OH)3+3H+ 因为Al(OH)3具有很强的吸附型,所以明矾可以做净水剂 14、铁
①物理性质:银白色光泽,密度大,熔沸点高,延展性,导电导热性较好,能被磁铁吸引。铁在地壳中的含量仅次于氧、硅、铝,排第四。 ②化学性质:
点燃 点燃 △
a、与非金属:Fe+S==FeS,3Fe+2O2===Fe3O4,2Fe+3Cl2===2FeCl3
△
b、与水:3Fe+4H2O(g)===Fe3O4+4H2
c、与酸(非氧化性酸):Fe+2H+==Fe2++H2↑
与氧化性酸,如硝酸、浓硫酸,会被氧化成三价铁 d、与盐:如CuCl2、CuSO4等,Fe+Cu2+==Fe2++Cu Fe2+和Fe3+离子的检验: ①溶液是浅绿色的
Fe2+ ②与KSCN溶液作用不显红色,再滴氯水则变红
③加NaOH溶液现象:白色灰绿色红褐色 ①与无色KSCN溶液作用显红色
Fe ②溶液显黄色或棕黄色
③加入NaOH溶液产生红褐色沉淀 15、硅及其化合物 Ⅰ、硅
硅是一种亲氧元素,自然界中总是与氧结合,以熔点很高的氧化物及硅酸盐的形式存在。硅有晶体
和无定型两种。晶体硅是带有金属光泽的灰黑色固体,熔点高、硬度大、有脆性,常温下不活泼。晶体硅的导电性介于导体和绝缘体之间,是良好的半导体材料,可制成光电池等能源。 Ⅱ、硅的化合物 ①二氧化硅
a、物理性质:二氧化硅具有晶体和无定形两种。熔点高,硬度大。 b、化学性质:酸性氧化物,是H2SiO3的酸酐,但不溶于水
高温
SiO2+CaO===CaSiO3,SiO2+2NaOH==Na2SiO3+H2O,SiO2+4HF==SiF4↑+2H2O
c、用途:是制造光导纤维德主要原料;石英制作石英玻璃、石英电子表、石英钟等;水晶常用来
制造电子工业的重要部件、光学仪器、工艺品等;石英砂常用作制玻璃和建筑材料。
②硅酸钠:硅酸钠固体俗称泡花碱,水溶液俗称水玻璃,是无色粘稠的液体,常作粘合剂、防腐剂、
耐火材料。放置在空气中会变质:Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3。实验室可以用可溶性硅酸盐与盐酸反应制备硅酸:Na2SiO3+2HCl==2NaCl+H2SiO3↓
③硅酸盐:
a、是构成地壳岩石的主要成分,种类多,结构复杂,常用氧化物的形式来表示组成。其表示方式 活泼金属氧化物·较活泼金属氧化物·二氧化硅·水。如:滑石Mg3(Si4O10)(OH)2可表示为3MgO·4SiO2·H2O
b、硅酸盐工业简介:以含硅物质为原料,经加工制得硅酸盐产品的工业成硅酸盐工业,主要包括
陶瓷工业、水泥工业和玻璃工业,其反应包含复杂的物理变化和化学变化。
水泥的原料是黏土和石灰石;玻璃的原料是纯碱、石灰石和石英,成份是Na2SiO3·CaSiO3·4SiO2;
陶瓷的原料是黏土。注意:三大传统硅酸盐产品的制备原料中,只有陶瓷没有用到石灰石。
16、氯及其化合物
①物理性质:通常是黄绿色、密度比空气大、有刺激性气味气体,能溶于水,有毒。
②化学性质:氯原子易得电子,使活泼的非金属元素。氯气与金属、非金属等发生氧化还原反应,一
般作氧化剂。与水、碱溶液则发生自身氧化还原反应,既作氧化剂又作还原剂。
拓展1、氯水:氯水为黄绿色,所含Cl2有少量与水反应(Cl2+H2O==HCl+HClO),大部分仍以分子形
---式存在,其主要溶质是Cl2。新制氯水含Cl2、H2O、HClO、H+、Cl、ClO、OH等微粒
拓展2、次氯酸:次氯酸(HClO)是比H2CO3还弱的酸,溶液中主要以HClO分子形式存在。是一种具
有强氧化性(能杀菌、消毒、漂白)的易分解(分解变成HCl和O2)的弱酸。
拓展3、漂白粉:次氯酸盐比次氯酸稳定,容易保存,工业上以Cl2和石灰乳为原料制取漂白粉,其
主要成分是CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2,须和酸(或空气中CO2)作用产生次氯酸,才能发挥漂白作用。
18、二氧化硫
①物理性质:无色,刺激性气味,气体,有毒,易液化,易溶于水(1:40),密度比空气大
②化学性质:
a、酸性氧化物:可与水反应生成相应的酸——亚硫酸(中强酸):SO2+H2O H2SO3
可与碱反应生成盐和水:SO2+2NaOH==Na2SO3+H2O,SO2+Na2SO3+H2O==2NaHSO3
b、具有漂白性:可使品红溶液褪色,但是是一种暂时性的漂白 c、具有还原性:SO2+Cl2+2H2O==H2SO4+2HCl 18、硫酸
①物理性质:无色、油状液体,沸点高,密度大,能与水以任意比互溶,溶解时放出大量的热
②化学性质:酸酐是SO
,其在标准状况下是固态 浓硫酸的三大特性
a、吸水性:将物质中含有的水分子夺去(可用作气体的干燥剂) b、脱水性:将别的物质中的H、O按原子个数比2:1脱出生成水 c、强氧化性:
ⅰ、冷的浓硫酸使Fe、Al等金属表面生成一层致密的氧化物薄膜而钝化
△ ⅱ、活泼性在H以后的金属也能与之反应(Pt、Au除外):Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O
△ ⅲ、与非金属反应:C+2H2SO4(浓硫酸)===CO2↑+2SO2↑+2H2O
ⅳ、与较活泼金属反应,但不产生H2
d、不挥发性:浓硫酸不挥发,可制备挥发性酸,如HCl:NaCl+H2SO4(浓)==NaHSO4+HCl 三大强酸中,盐酸和硝酸是挥发性酸,硫酸是不挥发性酸
2016江苏小高考化学(四)
江苏省2016年小高考化学常考必背知识点
高中化学学业水平测试复习纲要——必修1
1. 托盘天平精确到,量筒精确到。 2. 3.
4.
5.分离提纯的装置:
依次为:过滤、 蒸发、 蒸馏、 萃取(分液)。
6. (1)过滤用于分离固体和液体的混合物,主要仪器:漏斗。
(2)蒸发的主要仪器:蒸发皿。当蒸发皿中出现较多的固体时,停止加热。不可加热至蒸干。
(3)蒸馏用于分离液体混合物,(主要仪器包括蒸馏烧瓶,冷凝管)如:乙醇和水的混合物。冷凝水“下进上出”。 (4)萃取可用于提取碘水中的碘单质。主要仪器:分液漏斗;萃取剂不能溶于水,如四氯化碳,不可使用酒精。
(5)分液用于分离互不相溶的液体,如:乙酸乙酯和饱和Na2CO3溶液,植物油和水。主要仪器:分液漏斗。使用时注意“下层放、上层倒”。
-
7.1数值与该物质
的相对分子(原子)量相同(如氯化氢相对分子量为:36.5,摩尔质量为:36.5g/mol) 8. 22.4mol/L的使用条件:
①标准状况下(0℃ 101KPa);②气体。(注:水在标准状况下为液体)
9. 物质的量的计算的四个公式:
10. 溶液稀释的公式:
11. 配制一定物质的量浓度溶液必需的仪器:×× mL容量瓶、烧杯、玻璃棒、胶头滴管。 ..12.
有关物质的量在化学方程式计算中的应用做题步骤:
(1),将已经m,V气,c、V液计算成n,(2)列化学方程式将已知与待求的物质建立联系,求出待出物质的n(3)将求出的n转化为最终要求的m,V气,c、V液 13.
14. Fe(OH)3胶体的制备方法:是FeCl3+3+NaOH;区分胶体与溶液
的方法是:丁达尔效应(用光束照射有光亮的通路)。胶体与其它分散系本质区别是:分散质粒子直径在1~100nm之间而不是丁达尔效应。 15.

-
-
-
电解质。电离方程式:
如H2SO4= 2H++SO42 Ba(OH)2 =Ba2+ +2OH Na2CO3 = 2Na++ CO32 16. 在离子反应中可以拆开的物质:
强酸(HCl、H2SO4、HNO3)、
强碱[KOH、NaOH、Ba(OH)2、Ca(OH)2]、
可溶性盐(钾、钠、铵盐个个拆,硝酸盐类也相同,氯化物仅银(AgCl)不拆,
硫酸盐仅钡(BaSO4)不拆,碳酸盐拆钾钠铵,) 17. 离子方程式典型错误:
1) 电荷、原子不守恒,如:Fe+Fe3+=2Fe2+、Na+H2O=Na++OH-+H2 2) 拆分错误,如:
碳酸钙与稀盐酸反应不能写成:CO32+2H+ = CO2↑+H2O,
-
应写成:CaCO3+2H+ =Ca2++ CO2↑+H2O
3) 化学原理错误,如:Fe和HCl反应不能写成2Fe+6H+=2Fe3++3H2↑,
应写成Fe+2H+=Fe2++H2↑;
18. 不能与H+共存的离子有:OH2
-
-
-
19. 不能与OH++2+2+
-
-
20. 不能与CO32+++-
21. Cl不能与Ag+共存。 SO42不能与Ba2+共存。
-
-
22. 有色离子有:Cu2+(蓝色)、Fe3+(黄色)、Fe2+(浅绿色)、MnO4(紫红色)
-
23. 24.
反应前后元素化合价发生变化的反应是氧化还原反应。一般而言,有单质参与的氧化还原的口决:升 失 氧化(2) 还原剂(性);化合价升高的元素失去电子,
反应一定是氧化还原反应。
含该元素的反应物被氧化,发生了氧化反应,该物质是还原剂,具有还原性。 降 得 还原(2) 氧化剂(性)(与上解释方法相同)。 25. 26.
氧化还原相关分析首先从化合价变化入手。
化合价口诀:钾钠氢银铵正一,钙镁钡锌铜正二,铝铁正三,亚铁二,氢氧硝酸
氯负一,硫酸碳酸氧负二,其他元素需计算。 27. 金 28. 氢 29. 钠是质软、密度小、熔点低,遇盐溶液先和水反应。 30. 过
3233. 除杂Na2CO3(NaHCO3)方法:加热。除杂NaHCO3(Na2CO3)34. 铝 35. 既能与HCl反应又能与NaOH反应的物质有:
36. Al(OH)3的制备:AlCl3溶液中滴加氨水至过量 37. Al(OH)3不能溶于氨水中。 38. 不能一步实现的转化有:
39 40. 除杂Fe2O3(Al2O3)试剂:NaOH溶液 41. Fe2O3 Fe(OH)3 42. FeCl2中滴加NaOH红褐色,因为Fe(OH)2为白色沉淀,在空气中极易被氧化变成灰绿色,最后变为红褐色Fe(OH)3沉淀 43. 除杂FeCl2(FeCl3)方法:加铁粉
44. 除杂FeCl3(FeCl2)方法:通氯气或加氯水 45. 单 46. SiO2是制玻璃的原料,还可制光导纤维。 47. 常 48. 氯 49. Fe在Cl2中燃烧,生成50. H2在Cl2中燃烧,苍白色火焰。 51. 氯 52. 氯 53. 氯 54. 漂55. NO56. NO2红棕色﹑有刺激性气味的气体,易溶于水,有毒,NO2与水反应生成硝酸和NO 57. 二氧化硫:无色、有刺激性气味的气体,易溶于水,有毒 58. SO2可使品红溶液褪色,但加热后红色可以恢复 59. 浓H2SO4和C反应产生的SO2和CO2的鉴别现象:
A检验B除去,C检验不褪色,D变浑浊,说明
有CO2存在。
60. 制取氨气装置图:
选碱石灰。
而
61. NH3为无色﹑有刺激性气味的气体,密度比空气小,易溶于水形成氨水 62. 氨63. 铵64. 浓NH3)会反应。 65. 浓66.,不生成H2 67. 硝68.
常温下,铝或铁遇浓硫酸或浓硝酸发生钝化(化学变化)。 ..
高中化学学业水平测试复习纲要——必修2
1. 元素周期表的横行称为周期,共有18种元素。将前
18号元素填于下表中:
2.元素周期表的纵行称为族,共有ⅤA、ⅥA、ⅦA。【2016江苏小高考化学】
3. 元素非金属性越强,越容易与H2反应生成氢化物,其氢化物越稳定,其最高价含氧酸酸性越强。
4. 5. 6. 短周期元素中,原子半径最大的是 最活泼的金属是Na,最活泼的非金属是F,
最强的碱是NaOH,最强的含氧酸是HF。 7. 除稀有气体外,
8. Si 9. 核素的表达: 符号
,其中:质量数= A、 质子数= Z、 中子数= A-Z、 电子数= Z 原子序数=核电核数=质子数=原子的核外电子数 质量数(A)=质子数(Z)+中子数(N)
2016江苏小高考化学(五)
2016江苏学业水平测试题(化学)
绝密★启用前
2016年江苏省普通高中学业水平测试(必修科目)试卷
化 学
本卷可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32
Cl:35 .5 Fe:56 I:127 Ba:137.
一、单项选择题:在每题的4个选项中,只有1个选项是符合要求的(本部分23题,每题3分,共69分)。 1.在科学史上每一次重大的发现都极大地推进了科学的发展。俄国科学家门捷列夫对化学的突出贡献在于
A.提出了元素周期律 B.开发了合成氨的生产工艺 C.揭示了燃烧的本质 D.提取了治疟药物青蒿素 2.近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配
以相应的文字形成的(如右图所示)。苯()属于 A.氧化物 B.硫化物 C.无机物 D.有机物 3.下列变化属于物理变化的是
A.煤的燃烧 B.碘的升华 C.铜的锈蚀 D.铝的冶炼 4.研究化学反应常用18 8O作为示踪原子,该原子的质子数是 A.18 B.8 C.10 D.16 5.下列化学用语表示正确的是
A.氯气的电子式: B.乙烯的结构简式CH2CH2
C.钠原子的结构示意图:
+
-
D.硫酸亚铁的电离方程式FeSO
4Fe2+SO42 6.下列气体可用向上排空气法收集的是
A.NH3 B.H2 C.Cl2 D.CH4
7.实验室用大理石和盐酸制备CO2。下列措施可使反应速率加快的是 A.降低反应温度 B.延长反应时间 C.粉碎大理石 D.加水稀释盐酸 8.下列物质含有离子键的是
A.HCl B.NaCl C.N2 D.
NO
9.下列常见物质的俗名与化学式对应正确的是 A.烧碱--NaOH B.小苏打——Na2SO4 C.熟石灰——CaCl2 D.明矾——Al2(SO4)3
--2+
10.在含有大量的Ba、OH、Cl的溶液中,还可能大量共存的离子是
--++
A.CO32 B.NO3 C.H D.Fe3
11.实验室可用右图所示的装置制备少量氧气,下列说法正确的是 A.实验前需检查装置的气密性
B.当水槽中导管口一有气泡逸出时,就立即收集氧气 C.实验结束时先撤走酒精灯,再从水槽中取出导管 D.常温下将木条伸入盛有氧气的集气瓶中,木条自燃 12.下列属于吸热反应的是
A.镁的燃烧反应 B.盐酸与氢氧化钠的反应 C.水的分解反应 D.铝与氧化铁的铝热反应 13.工业上可用金属钠和氯化钾反应制备金属钾,期化学方程式为:Na+KClNaCl+K↑。该反应属于
A.置换反应 B.复分解反应 C.分解反应 D.化合反应 14.下列有关甲烷的说法正确的是
A.易溶于水 B.是天然气的主要成分 C.与氯气发生加成反应 D.与乙烷互为同分异构体 15.工业上制备硝酸的一个重要反应为:4NH3+5O
2
4NO+6H2O。下列有关该反应的说法正确
的是
A.O2是还原剂 B.NH3是氧化剂 C.O2失去电子 D.NH3发生氧化反应 16.用NA表示阿伏伽德罗常数的值。下列判断正确的是 A.1mol H2含有的分子数目为NA
+
B.24g Mg变为Mg2时失去的电子数目为NA
--
C. 1L 1mol·L1CaCl2溶液中含有的Cl离子数目为NA D.常温常压下,11.2LO2中含有的原子数目为NA 17.下列反应的离子方程式书写正确的是
+
A.FeCl3溶液与Cu反应:Fe3+ Cu = Fe2+ + Cu2+
+—
B.AgNO3溶液与NaCl反应:Ag + Cl = AgCl↓
—
C.Cu(OH)2与CH3COOH反应:OH+ H+=H2O
-+
D.CaCO3与HNO3反应:CO32+2H = H2O + CO2↑ 18.下列实验方法能达到实验目的的是 A.用分液漏斗从食醋中分离出乙酸 B.用焰色反应鉴别Na2SO4和Na2CO3
C.用NaOH溶液除去Cl2中含有的少量HCl
+
D.用KSCN溶液检验FeCl3溶液 中是否含有Fe3 19.右图是土豆电池的示意图。土豆电池工作时,
下列有关说法正确的是 A.Fe用作正极 B.Cu片质量减少
C.电子由Fe并经导线流向Cu片 D.实现了电能向化学能的转化
20.在化学魔术中,一张白纸在用碘溶液喷洒后会呈现出蓝色字迹,其奥秘在于这张白纸曾经一种“隐秘墨水”书写过。这种“隐秘墨水”为
A.食盐水 B.白醋 C.淀粉溶液 D.蔗糖溶液 21.下列有关乙醇性质的化学方程式正确的是 A.与金属钠反应: 2CH3CH2OH+2Na2CH3CH2ONa+H2↑
Cu
B.与氧气的燃烧反应:2CH3CH2OH+O2―△―→2CH3CHO+2H2O
点燃 C.与氧气的催化氧化:CH3CH2OH+3O22CO2+3H2O
D.与乙酸的酯化反应:CH3COOH+CH3CH2OH
CH3COOCH2CH【2016江苏小高考化学】
3
22.X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5:4。下列说法正确的是 A.原子半径:r(W)>r(Z)>r(Y)>r(X) B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应 D.由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
-
23.将5.10g镁铝合金加入120mL4.0mol·L1的盐酸中,待合金完全溶解后,得到溶液X。下列说法一定正确的是
A.合金完全溶解后产生的H2的物质的量为0.24mol B.合金中的镁与铝的物质的量之比小于1
-
C.若向溶液X中加入270mL2.0mol·L1NaOH溶液,充分反应,所得沉淀为Mg(OH)2
D.若向溶液X中加入足量的氨水,充分反应,所得沉淀经过过滤、洗涤后充分灼烧,则残留固体质
量大于8.50g.
二、非选择题(本部分3题,共31分) 24.(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基
础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。 A.《化学与生活》
(1)(3分)2015年11月首架C919打飞机总装下线,标志着我
国跻身飞机研制先进国家行列。
①机身蒙皮使用的是第三代铝锂合金材料。下列不属于铝锂 合金性质的是 ▲ (填字母)。
a.密度大 b.硬度大 c.抗腐蚀
②飞机轮胎属于橡胶制品。下列材料可用来合成橡胶的是
▲ (填字母)。
a.石英砂 b.石灰石 c.异戊二烯
③机体先进复合材料的使用率达12%。下列属于复合材料的是。 a.钛合金 b.玻璃钢 c.普通陶瓷
(2)(5分)秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰
富的铁、锌、钙等元素,其中:
①属于人体所需微量元素的是 ▲ 。 ②属于水溶性维生素的是
。
③蛋白质在人体内最终的水解产物是 ▲ 。 (3)(7分化学能帮助我们更好地认识生活、改善生活。
①家用铁锅未洗净晾干,放置一段时间后出现红褐色锈斑,其主要的原因是铁发生了 ②乘车禁止携带物品的部分标识如右图所示。在
浓硝酸、食盐、汽油、石膏四种物品中,不能 携带上车的是 ▲ 。
③过氧乙酸()易分解为乙酸和氧气,
其稀溶常用于餐具、器械的消毒。协会粗过氧乙酸分解的化学方程式 ▲ 。某胃药的主要成分是AlbMgc(OH)mCO3,常用于治疗胃酸过多,写出其中与胃酸反应的化学方程式 ▲ 。 25.(6分)有关物质的转化关系如下图所示(部分生成物与反应条件已略去)。A是常见的非金属固体单
质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I
的组成元素相同,
且D的相对分子质量比I的大16。E是最常见的无色液体。
请回答下列问题:
(1)E的电子式为 (2)H的化学式为。
(3)写出反应①的化学方程式:。
(4)写出反应③的离子方程式:。 26.(10分)亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下: NaOH溶液 SO2 Na2SO3产品 Na2CO3
查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中, 溶液中有关组分的质量分数变化如右图是所示。
(1)右图中的线2表示的组分为 ▲ (填化学式) (2)实验时,“反应II”中加入NaOH溶液的目的
是 ▲ (用化学方程式表示)
(3)国家标准规定产品中Na2SO3的质量分数≥97.0%
为优等品,≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了两种方法进行测定。 ①方法I:称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,在加
入过量的BaCl2溶液,所得沉淀经过过滤、洗涤、干燥后称量,质量为4.660g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)
②方法II:称取1.326g产品,配成100mL溶液,取25.00mL该溶液,滴加0.1250mol/L I2溶液,恰好使Na2SO3完全氧化生成Na2SO4时,消耗I2溶液20.00mL。通过计算确定产品中Na2SO3的质量分数(写出计算过程)
③判断Na2SO3产品的等级,并说明理由。
2016年江苏省普通高中学业水平测试(必修科目)试卷
化学参考答案
一、单项选择题(共69分)
24.(15分) A.《化学与生活》 (1)(3分)
①a ②c ③b
(2)(5分)
①铁、锌
②维生素C 纤维素 (3)(7分) ①电化学 ② 浓硝酸、汽油
③2CH3COOH→2CH3COOH+O2↑;
2AlbMgc(OH)mCO3 +(6b+4c) HCl=2b AlCl3+2cMgCl2+(3b+2c+m)H2O+2CO2↑
25.(6分) (1)
(2)CuSO4
(3)S+6HNO3 (浓) (4)H2O+NO2+SO226.(10分)
H2SO4+6NO2↑+H2O 2H+SO42+NO
+
-
(1)NaHCO3
(2)NaHSO3+NaOH=Na2SO3+H2O (3)①98.05%
②95.02%
③产品为一等品。产品中含有的硫酸钠和碳酸钠,在方案I的测定中,硫酸钠和碳酸钠杂质使得
测定值偏高。而方案II是直接测定亚硫酸钠,更可信。
2016江苏小高考化学(六)
2016江苏小高考化学试卷答案解析【真题】
2016年江苏小高考化学的试题及答案,在中国招生考试网上会在2016年3月20日之后进行发布,请各位老师耐心等待中国招生考试网的发布和整理。2016年江苏小高考化学的具体的考试时间是:10:45-12:00
请各位考生注意进行化学科目的重点知识点的复习和整理。
>>>【点击下载】2016江苏小高考生物试卷答案<<<
下面是中国招生考试网整理的2015年的江苏小高考化学的试题及答案,各位考生可以参考一下: