浙江小高考化学
成考报名 发布时间:09-23 阅读:
浙江小高考化学(一)
2016江苏小高考化学试卷答案解析【真题】
2016年江苏小高考化学的试题及答案,在中国招生考试网上会在2016年3月20日之后进行发布,请各位老师耐心等待中国招生考试网的发布和整理。2016年江苏小高考化学的具体的考试时间是:10:45-12:00
请各位考生注意进行化学科目的重点知识点的复习和整理。
>>>【点击下载】2016江苏小高考生物试卷答案<<<
下面是中国招生考试网整理的2015年的江苏小高考化学的试题及答案,各位考生可以参考一下:



浙江小高考化学(二)
2015年浙江省高考化学试卷附详细解析
2015年浙江省高考化学试卷
一、选择题(共7小题,每小题6分,满分42分)
9.(6分)(2015•浙江)如表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,X元素的2倍.下列说法正确的是( )
11.(6分)(2015•浙江)在固态金属氧化物电解池中,高温共电解H2O﹣CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
12.(6分)(2015•浙江)40℃时,在氨﹣水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )
13.(6分)(2015•浙江)某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4•7H2O)
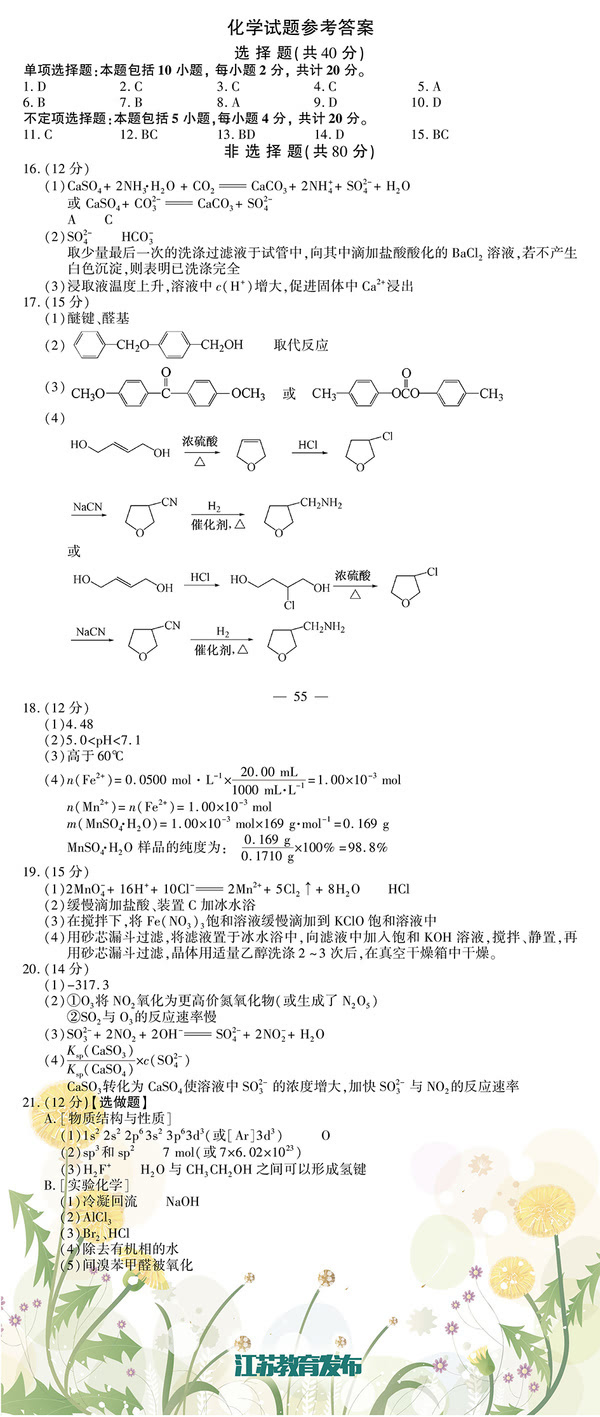
,设计了如下流程:
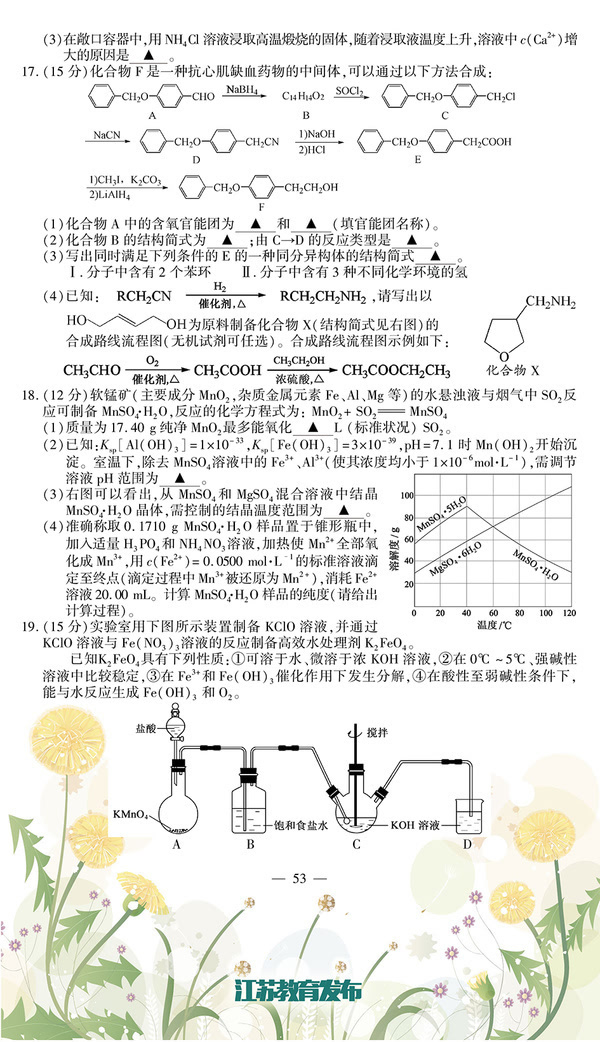
二、非选择题: 26.(10分)(2015•浙江)化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
已知:RX
ROH;RCHO+CH3COOR′
RCH=CHCOOR′
请回答:
(1)E中官能团的名称是 . (2)B+D→F的化学方程式 . (3)X的结构简式 .
(4)对于化合物X,下列说法正确的是 . A.能发生水解反应 B.不与浓硝酸发生取代反应 C.能使Br2/CCl4溶液褪色 D.能发生银镜反应
(5)下列化合物中属于F的同分异构体的是 .
A. B.
C.CH2=CHCH=CHCH=CHCH=CHCOOH D. 27.(18分)(2015•浙江)Ⅰ.请回答:
(1)H2O2的电子式 .
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由 .
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式 .
(4)完成以下氧化还原反应的离子方程式:
MnO4+C2O4++ CO2↑+
Ⅱ.化合物甲和NaAlH4都是重要的还原剂.一定条件下金属钠和H2反应生成甲.甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4.将4.80g甲加热至完全分解,得到金属钠和2.24L(已折算成标准状况)的H2. 请推测并回答:
(1)甲的化学式 .
(2)甲与AlCl3反应得到NaAlH4的化学方程式 . (3)NaAlH4与水发生氧化还原反应的化学方程式 .
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式 .
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到的固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的.
判断该同学设想的制备和验纯方法的合理性并说明理由 . 28.(15分)(2015•浙江)乙苯催化脱氢制苯乙烯反应:【浙江小高考化学】
﹣
2﹣2+
计算上述反应的△H= kJ•mol.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K= (用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实 ②控制反应温度为600℃的理由是.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺﹣﹣﹣﹣乙苯﹣二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有 (填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移 ②不用高温水蒸气,可降低能量消耗 ③有利于减少积炭
④有利用CO2资源利用. 29.(15分)(2015•浙江)某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取. 实验(一) 碘含量的测定
取0.0100mol•L的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用
﹣
另制海带浸取原液,甲、乙两种实验方案如下:
﹣1
已知:3I2+6NaOH═5NaI+NaIO3+3H2O
浙江小高考化学(三)
2015年浙江省高考化学试题和答案解析
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27
S 32 Fe 56 Ag 108 I 127
7.下列说法不正确的是 ...
A.液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性
B.常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关
C.石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 D.燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 8.下列说法正确的是
A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸
石,应立即停止加热,冷却后补加
C.在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知
溶液中存在SO42或SO32
-
-
D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
9.右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核 电荷
数为X元素的2倍。下列说法正确的是
A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3气化均需克服分子间作用力
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原
性
10.下列说法不正确的是 ...
A.己烷有4种同分异构体,它们的熔点、沸点各不相同
B.在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应
C.油脂皂化反应得到高级脂肪酸盐与甘油
D.聚合物(—[CH2—CH2—CH—CH2—]n)可由单体CH3CH=CH2和CH2=CH2加聚制得
|CH3
11.在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的
能源利用方式,
基本原理如图所示。下列说法不正确的是
...
A.X是电源的负极
B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ
CO2+2eˉ=CO+O2ˉ
C.总反应可表示为:H2O+CO2====H2+CO+O2 D.阴、阳两极生成的气体的物质的量之比是1︰1
12.40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不.
正确的是 ..
通电
2
A.在pH=9.0时,c(NH4+)>c(HCOˉ3)>c(NH2COOˉ)>c(CO3)
-
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32)+c(HCO3)+c(NH2COOˉ)
-
-
+c(OHˉ)
c(OHˉ)C.随着CO2的通入,不断增大
c(NH3·H2O)
D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
13.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂
质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
下列说法不正确的是
...
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经
结晶分离也可得到FeSO4·7H2O
26.(10分)化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
NaOH/H2OROH;RCHO+CHCOOR’――――――→CH3CH2ONaRCH=CHCOOR’ 已知:RX―――――→3请回答:
(1)E中官能团的名称是 。 (2)B+D→F的化学方程式 。 (3)X的结构简式 。
(4)对于化合物X,下列说法正确的是 。
A.能发生水解反应 B.不与浓硝酸发生取代反应 C.能使Br2/CCl4溶液褪色 D.能发生银镜反应 (5)下列化合物中属于F的同分异构体的是 。
27.Ⅰ.(6分) 请回答:
(1)H2O2的电子式___________。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________。 (3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方
程式_____________。
(4)完成以下氧化还原反应的离子方程式:
( )MnO4+( )C2O42+______=( )Mn2++( )CO2↑+________
-
-
Ⅱ.(12分) 化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。
甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。将4.80g甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的H2。 请推测并回答:
(1)甲的化学式__________。
(2)甲与AlCl3反应得到NaAlH4的化学方程式__________。 (3)NaAlH4与水发生氧化还原反应的化学方程式__________。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过
程发生反应的化学方程式 。
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓
硫酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的。
判断该同学设想的制备和验纯方法的合理性并说明理由___________。
28.(15分)乙苯催化脱氢制苯乙烯反应:
(1)已知:
计算上述反应的△H=________ kJ·mol1。
-
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生
催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为
1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
浙江小高考化学(四)
2014年浙江浙江省高考化学试题及答案
2014年普通高等学校招生全国统一考试(浙江卷)
理科综合化学试题
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 K-39 Ca-40 Fe-56 Cu-64 Ba-137 7.下列说法不正确的是 ... A.光催化还原水制氢比电解水制氢更节能环保、更经济
B.氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 C.某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V≈10推算该检测技术能测量细胞内浓度约为108.下列说法正确的是
A.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
B.用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 量偏大,则测得的NaOH溶液浓度比实际浓度偏小
D.向某溶液中加入茚三酮试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质
9.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是
A.X、Y、Z三种元素最低价氢化物的沸点依次升高(氢键)
B.由X、Y和氢三种元素形成的化合物中只有共价键(HNO3或NH4NO3) C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性(SiCl4分子晶体) D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 10.下列说法正确的是
A.乳酸薄荷醇酯( )仅能发生水解、氧化、消去反应(烃基被取代) B.乙醛和丙烯醛(
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C.邻苯二甲酸氢钾可用于标定NaOH溶液的浓度。假如称量邻苯二甲酸氢钾时电子天平读数比实际质
-12
-12
L)内的数个目标分子,据此可
~10
-11
mol·L
-1
的目标分子
D.向汽油中添加甲醇后,该混合燃料的热值不变
C.淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别(峰的位置不同,可鉴别)
11.镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M = NiOOH + MH 已知:6NiOOH + NH3 + H2O + OH =6 Ni(OH)2 + NO2 下列说法正确的是
-
-
-
-
-
A.NiMH 电池放电过程中,正极的电极反应式为:NiOOH + H2O + e= Ni(OH)2 + OH B.充电过程中OH离子从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O + M + e= MH + OH,H2O中的H被M还原

-
-
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 12.氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO强。25℃时氯气-氯水体系中存在以下平衡关系: Cl2(g) HClO
Cl2(aq) K1=10
HClO + H+ +Cl K2=10
-
-
-
-1.2
-
Cl2(aq)+ H2O
-3.4
H+ + ClO Ka=?
其中Cl2(aq)、HClO和ClO分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是 A.Cl2(g)+ H2O
2H+ + ClO + Cl K=10-10.9
-
--
-
B.在氯处理水体系中,c(HClO) + c(ClO) =c(H+)-c(OH) C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好(Cl2溶解度而挥发或HClO易分解)
13.雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42、NO3、Cl 。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并
-
-
-
完成了如下的实验:
已知:3NO3 + 8Al + 5OH + 2H2O
-
-
3NH3 + 8AlO2
-
根据以上的实验操作与现象,该同学得出的结论不正确的是 ... A.试样中肯定存在NH4+、Mg2+、SO42和NO3
-
-
B.试样中一定不含Al3+ C.试样中可能存在Na+、Cl
-
D.该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
26.(15分)某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1。请回答如下问题: ⑴画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。 Ca的原子结构示意图 CO2的电子式
⑵X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。 CaFe(CO3)2 CaFe(CO3)2≜CaO+FeO+2CO2↑
⑶白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。 4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑷一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
3FeO+3CO2=Fe2O3+3CO(或生成Fe3O4),取样品于试管中,加盐酸溶解,再加KSCN溶液,若显红色,则证明产物中有Fe2O3 或Fe3O4的检验
27.(14分)煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下: CaSO4(s)+CO(g) CaSO4(s)+4CO(g) 请回答下列问题:
⑴反应Ⅰ能自发进行的条件是 。 加热(△H>0,△S>0,升温有利于自发)
⑵对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp(用表达式表示)。 Kp=p4(CO2)/p4(CO)
⑶假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol1(反应Ⅱ)
-
A B C D
活化能低反应速率快
⑷通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是 。
可以。CaSO4(s)+CO(g)⇌CaO(s) + SO2(g) + CO2(g) (反应Ⅰ) CaSO4(s)+4CO(g)⇌ CaS(s) + 4CO2(g) (反应Ⅱ)。c(SO2)变化可推知反应Ⅰ是否反应,通过c(SO2)与c(CO2)或c(CO)的变化可推测反应是否反应Ⅱ是否反应
⑸图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有 。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温度 C.提高CO的初始体积百分数
D.提高反应体系的温度
CaSO4(s)+CO(g)⇌CaO(s) + SO2(g) + CO2(g) (反应) ΔH1=218.4kJ·mol-1 ;CaSO4(s)+4CO(g)⇌CaS(s) + 4CO2(g) (反应Ⅱ) ΔH2= -175.6kJ·mol
-1
BC
CO体积分数增大,则CaS质量百分数增大,则c(CO2)浓度增大对反应Ⅰ逆移,SO2减少,反应Ⅱ为等体反应。
⑹恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,则下,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。

因反应Ⅰ速率快,c(SO2)先增大快,随着反应Ⅱ进行,使c(CO2)浓度增大,反应Ⅰ逆移,故图象为
28.(14分)葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得: C6H12O6(葡萄糖) + Br2 + H2O → C6H12O7(葡萄糖酸) + 2HBr
2C6H12O7(葡萄糖酸) + CaCO3 → Ca(C6H11O7)2(葡萄糖酸钙) + H2O + CO2↑ 相关物质的溶解性见下表:
实验流程如下:
C6H12O6溶液悬浊液Ca(C6H11O7)2 请回答下列问题:
⑴第①步中溴水氧化葡萄糖时,下列装置最适合的是________。 B(优点:恒压漏斗易控,吸收HBr防倒吸)
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。 A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液 C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
AD(酸性KMnO4溶液氧化太强,氧化为更复杂氧化物,O2/葡萄糖氧化酶氧化产物非葡萄糖酸) ⑵第②步充分反应后CaCO3固体需有剩余,其目的是________;本实验中不宜用CaCl2替代CaCO3,理由是________。
(除去过量的溴水和将葡萄糖酸转化为葡萄糖酸钙);CaCl2替代在乙醇中可溶,难以除去。(CaCl2不易将葡萄糖酸转化葡萄糖酸钙,也不能除去过量酸性杂质。) ⑶第③步需趁热过滤,其原因是________。 防止温度降低时,葡萄酸钙析出而损失 ⑷第④步加入乙醇的作用是________。 溶解溴化钙,除去溴化钙杂质
⑸第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液 C(洗涤的目的除去溴化钙杂质,减少葡萄酸钙损失)
29.(15分)某兴趣小组以苯和乙烯为主要原料,采用以下路线合成药物普鲁卡因:
已知:
⑴对于普鲁卡因,下列说法正确的是________。
A.可与浓盐酸形成盐 B.不与氢气发生加成反应 C.可发生水解反应 D.能形成内盐
浙江小高考化学(五)
2016年浙江省高考化学试卷
2016年浙江省高考化学试卷
一、选择题(共7小题,每小题6分,满分42分)
1.(6分)(2016•浙江)下列说法不正确的是( )
A.储热材料是一类重要的存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较大的热量
B.Ce(32号元素)的单晶可以作为光电转换材料用于太阳能电池
2+C.Ba浓度较高时危害健康,但BaSO4可服入体内,作为造影剂用于X﹣射线检查肠胃道疾病
D.纳米铁粉可以高效地去除被污染水体中的Pb,Cu,Cd,Hg等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
2.(6分)(2016•浙江)下列叙述不正确的是( )
A.钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火
B.探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高
C.蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
D.为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管加蒸馏水至刻度线
3.(6分)(2016•浙江)短周期主族元素X,Y,Z,W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X,Y的核电荷数之比为3:4,W的最外层为8电子结构,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,下列说法正确的是( )
A.X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B.原子半径大小:X<Y,Z>W
C.化合物Z2Y和ZWY3都只存在离子键
D.Y,W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
4.(6分)(2016•浙江)下列说法正确的是. ﹣2+2+2+2+
A.的一溴代物和的一溴代物都有4种(不考虑立体异构)
B.CH3CH=CHCH3分子中的四个碳原子在同一直线上
C.按系统命名法,化合物
烷 的名称是2,3,4﹣三甲基﹣2﹣乙基戊
D.与都是α﹣氨基酸且互为同系物
5.(6分)(2016•浙江)金属(M)﹣空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:
4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg,Al,Zn三种金属﹣空气电池,Al﹣空气电池的理论比能量最高
C.M﹣空气电池放电过程的正极反应式:4M+nO2+2nH2O+4ne=4M(OH)n
D.在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
6.(6分)(2016•浙江)苯甲酸钠(
﹣+﹣,缩写为NaA)可用作饮料的防腐剂,研究﹣5表明苯甲酸(HA)的抑菌能力显著高于A,已知25℃时,HA的Ka=6.25×10,H2CO3
﹣7﹣11的Ka1=4.17×10,Ka2=4.90×10,在生产碳酸饮料的过程中,除了添加NaA外,还需加

压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
﹣B.提高CO2充气压力,饮料中c(A)不变
C.当pH为5.0时,饮料中=0.16
+﹣D.碳酸饮料中各种粒子的浓度关系为:c(H)=c(HCO3)+c(CO3)+c(OH)﹣c
(HA)
+7.(6分)(2016•浙江)为落实“五水共治”,某工厂拟综合处理含NH4废水和工业废气(主
要含N2,CO2,SO2,NO,CO,不考虑其他成分),设计了如下流程:
2﹣﹣
下列说法不正确的是( )
A.固体Ⅰ中主要含有Ca(OH)2、CaCO3、CaSO3
B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含NH4废水时,发生反应的离子方程式为:NH4+NO2=N2↑+2H2O
二、非选择题(共5小题,满分58分)
8.(10分)(2016•浙江)化合物X是一种有机合成中间体,Z是常见的高分子化合物,某研究小组采用如下路线合成X和Z: ++﹣
已知:①化合物A的结构中有2个甲基
②RCOOR′+R″CH2COOR
′
请回答:
(1)写出化合物E的结构简式 ,F中官能团的名称是 ;
(2)Y→Z的化学方程式是 ;
(3)G→X的化学方程式是 ,反应类型是 ;
(4)若C中混有B,请用化学方法检验B的存在(要求写出操作、现象和结论) .
9.(6分)(2016•浙江)化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)427H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据 ;
(2)用离子方程式表示除去固体产物中Al2O3的原理 ;
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理
10.(12分)(2016•浙江)磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
请回答:
(1)A的组成元素为 (用化学符号表示),化学式为 ;
(2)C溶液可溶解铜片,例举该反应的一个实际应用 ;
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为
1.518g•L),该气体分子的电子式为 ,写出该反应的离子方程
式 ;
(4)写出F→G反应的化学方程式,设计实验方案探究溶液G中的主要微粒(不考虑H2O,
﹣++H,K,I) .【浙江小高考化学】
11.(15分)(2016•浙江)催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=﹣53.7kJ•mol
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2 Ⅱ ﹣8 ﹣1Ⅰ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为﹣283.0kJ•mol
﹣1②H2O(1)═H2O(g)△H3=44.0kJ•mol
请回答(不考虑温度对△H的影响): ﹣1和﹣285.8kJ•mol. ﹣1
(1)反应I的平衡常数表达式K= ;反应Ⅱ的△H2=
kJ•mol.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有
.
A.使用催化剂Cat.1
B、使用催化剂Cat.2
C、降低反应温度
D、投料比不变,增加反应物的浓度
E、增大 CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 .
(4)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程﹣能量”示意图.
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在 极,该电极反应式是 . ﹣1
12.(15分)(2016•浙江)无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴.【浙江小高考化学】
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中.
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚溴化镁粗品.
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品.
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性.
②MgBr2+3C2H5OC2H5⇌MgBr2•3C2H5OC2H5
请回答:
(1)仪器A的名称是 .实验中不能用干燥空气代替干燥N2,原因
是 .
(2)如将装置B改为装置C(图2),可能会导致的后果是 .
(3)步骤3中,第一次过滤除去的物质是 .
(4)有关步骤4的说法,正确的是 .
A、可用95%的乙醇代替苯溶解粗品
B、洗涤晶体可选用0℃的苯
C、加热至160℃的主要目的是除去苯
D、该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式: Mg+Y═MgY
①滴定前润洗滴定管的操作方法是.
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol•L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是 (以质量分数表示).
﹣12+4﹣2﹣
浙江小高考化学(六)
2016浙江高考化学试题及答案(理综+自选)
绝密★考试结束前
浙江卷·理科综合·化学部分
可能用到的相对原子质量:
H 1 Li 7 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Ca 40 Fe 56 Zn 65 Br 80 Ag 108
7.下列说法不正确的是 ...A.储热材料是一类重要的能量存储物质,单位质量的储热材料在发生熔融或结晶时会
吸收或释放较大的热量
B.Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
C.Ba2+浓度较高时危害健康,但BaSO4可服人体内,作为造影剂用于X-射线检查肠
胃道疾病
D.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,
其本质是纳米铁粉对重金属离子较强的物理吸附
8.下列叙述不正确的是 ...A.钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火
B.探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再
用水浴加热至设定温度,则测得的反应速率偏高
C.蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
D.为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度
线时,改用滴管滴加蒸馏水至刻度线
9.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子
层数的2倍,X、Y的核电荷数之比为3∶4。W‾的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是 A.X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应 B.原子半径大小:X<Y,Z>W
C.化合物Z2Y和ZWY3都只存在离子键
D.Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂 10.下列说法正确的是
CH3∣
CH3的一溴代物和CH3CHCH2CH3的一溴代物都有4种(不考虑立体异构)
A.
B.CH3CH=CHCH3分子中的四个碳原子在同一直线上
CH3CH3∣∣
C.按系统命名法,化合物H3C-C-CH-CH-CH3的名称是2,3,4-三甲基-2-乙基戊烷
∣∣CH2CH3CH3D.
HOCH3CH2CHCOOH
2
与
HOCH2CHCOOH
2
都是α-氨基酸且互为同系物
11.金属(M)-空气电池(如图)具有原料易得、能量密度
高等优点,有望成为新能源汽车和移动设备的电源。
该类电池放电的总反应方程式为:
4M+nO2+2nH2O=4M(OH)n 已知:电池的“理论比能量”指单位质量的电极材料
理论上能释放出的最大电能。下列说法不正确的是 ...
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电
极表面
B.比较Mg、Al、Zn三种金属-空气电池,Al-空气电池的理论比能量最高
C.M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne‾=4M(OH)n
D.在M-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换
膜 12.苯甲酸钠(
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的
HA的Ka=6.25×10‾5,H2CO3的Ka1=4.17×10‾7,抑菌能力显著高于A‾。已知25℃时,
Ka2=4.90×10‾11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分) A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 B.提高CO2充气压力,饮料中c(A‾)不变 C.当pH为5.0时,饮料中
c(HA)
=0.16 c(A‾)
2
D.碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO‾3)+c(CO3‾)+c(OH‾)-c(HA) 13.为落实“五水共治”,某工厂拟综合处理含NH+4废水和工业废气(主要含N2、CO2、SO2、
NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是 ...
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3 B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
+
D.处理含NH+4废水时,发生反应的离子方程式为:NH4+NO‾2=N2↑+2H2O
26.(10分)化合物X是一种有机合成中间体,Z是常见的高分子化合物,某研究小组采用
如下路线合成X和Z:
已知:① 化合物A的结构中有2个甲基
R''
∣
CHCHONa32
② RCOOR'+R''CH2COOR'——————→RCOCHCOOR'
请回答:
(1) 写出化合物E的结构简式________,F中官能团的名称是________。 (2) Y→Z的化学方程式是________。
(3) G→X的化学方程式是________,反应类型是________。 (4) 若C中混有B,请用化学方法检验B的存在(要求写出操作、现象和结论)________。
27.Ⅰ.(6分)化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程
△
式分解:2Mg5Al3(OH)19(H2O)4=====27H2O↑+10MgO+3Al2O3
(1) 写出该化合物作阻燃剂的两条依据________。
(2) 用离子方程式表示除去固体产物中Al2O3的原理________。
(3) 已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理________。
Ⅱ.(12分)磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组
成:
请回答:
(1) A的组成元素为________(用元素符号表示),化学式为________。 (2) 溶液C可溶解铜片,例举该反应的一个实际应用________。
(3) 已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度
为1.518 g·L‾1),该气体分子的电子式为________。写出该反应的离子方程式________。
(4) 写出F→G反应的化学方程式________。设计实验方案探究溶液G中的主要微粒(不
考虑H2O、H+、K+、I‾)________。
28.(15分)催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO
催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol‾1 Ⅰ CO2(g)+H2(g)CO(g)+H2O(g) ΔH2 Ⅱ
某实验室控制CO2和H2初始投料比为1∶2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) 543 543 553 553
催化剂 Cat.1 Cat.2 Cat.1 Cat.2
CO2转化率(%)
12.3 10.9 15.3 12.0
甲醇选择性(%)
42.3 72.7 39.1 71.6
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;
甲醇选择性:转化的CO2中生成甲醛的百分比
已知:① CO和H2的标准燃烧热分别为-283.0 kJ·mol‾1和-285.8 kJ·mol‾1
② H2O(l)=H2O(g) ΔH3=44.0 kJ·mol‾1 请回答(不考虑温度对ΔH的影响):
(1) 反应Ⅰ的平衡常数表达式K=________;反应Ⅱ的ΔH2=________kJ·mol‾1。 (2) 有利于提高CO2转化为CH3OH平衡转化率的措施有________。
A.使用催化剂Cat.1 B.使用催化剂Cat.2 C.降低反应温度
D.投料比不变,增加反应物的额浓度 E.增大CO2和H2的初始投料比 (3) 表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有
显著的影响,其原因是________。 (4) 在下图中分别画出反应Ⅰ在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~
能量”示意图。 ...
能
量反应过程
(5) 研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在
________极,该电极反应式是________。
29.(15分)无水MgBr2可用作催化剂。实验室采用镁屑
与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160 ℃分解得无水MgBr2产品。
已知:① Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
② MgBr2+3C2H5OC2H5MgBr2·3C2H5OC2H5 请回答:
(1) 仪器A的名称是________。
实验中不能用干燥空气代替干燥N2,原因是________。
(2) 如将装置B改为装置C(图2),可能会导致的后果是________。 (3) 步骤3中,第一次过滤除去的物质是________。 (4) 有关步骤4的说法,正确的是________。
A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醇和可能残留的溴
(5) 为测定产品的纯度,可用EDTA(简写为Y4‾)标准溶液滴定,反应的离子方程式:
Mg2++Y4‾=MgY2‾
① 滴定前润洗滴定管的操作方法是________。 ② 测定前,先称取0.2500 g无水MgBr2产品,溶解后,用0.0500 mol·L‾1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________(以质量分数表示)。
