дёүжҳҜзӘҒеҮәйҮҚзӮ№,иҰҶзӣ–е…ЁйқўгҖӮз»“еҗҲе…·дҪ“еҢ»з–—еҷЁжў°жҠҪжЈҖе“Ғз§Қе’ҢжҲ‘иҫ–еҢәе®һйҷ…жғ…еҶө,гҖӮ
зј–иҫ‘: жҲҗиҖғжҠҘеҗҚ еҸ‘еёғж—¶й—ҙпјҡ08-31 йҳ…иҜ»пјҡ
зҜҮдёҖ:дёүжҳҜзӘҒеҮәйҮҚзӮ№,иҰҶзӣ–е…ЁйқўгҖӮз»“еҗҲе…·дҪ“еҢ»з–—еҷЁжў°жҠҪжЈҖе“Ғз§Қе’ҢжҲ‘иҫ–еҢәе®һйҷ…жғ…еҶө,гҖӮ
еҢ»з–—еҷЁжў°дё“йЎ№жЈҖжҹҘе·ҘдҪңжҖ»з»“
**еҺҝйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖ
е…ідәҺжҠҘйҖҒеҢ»з–—еҷЁжў°дё“йЎ№жЈҖжҹҘе·ҘдҪңжҖ»з»“
зҡ„жҠҘе‘Ҡ
еёӮйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖпјҡ
ж №жҚ®гҖҠе®үеә·еёӮйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖе…ідәҺејҖеұ•иҚҜе“ҒзЁҪжҹҘдә®еү‘иЎҢеҠЁе·ҘдҪңйҖҡзҹҘгҖӢ(е®үйЈҹиҚҜзӣ‘еҸ‘
[2012]116еҸ·)ж–Ү件зҡ„иҰҒжұӮпјҢ**еҺҝйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖз§ҜжһҒе®үжҺ’йғЁзҪІпјҢи®Өзңҹз»„з»Үе®һж–ҪгҖӮеҜ№иҫ–еҢәеҶ…еҢ»з–—еҷЁжў°з»ҸиҗҘдҪҝз”ЁеҚ•дҪҚиҝӣиЎҢдәҶдёҖж¬ЎеҪ»еә•иҖҢжңүж•Ҳзҡ„ж•ҙйЎҝе’Ң规иҢғпјҢдҝқиҜҒдәҶдәәж°‘зҫӨдј—зҡ„з”Ёжў°е®үе…ЁгҖӮзҺ°е°Ҷдё“йЎ№ж•ҙжІ»е·ҘдҪңжҖ»з»“еҰӮдёӢпјҡ
1гҖҒ жҲҗз«Ӣз»„з»Үжңәжһ„пјҢзЎ®дҝқдё“йЎ№ж•ҙжІ»е·ҘдҪңиҗҪеҲ°е®һеӨ„
дёәдәҶдҪҝжЈҖжҹҘе·ҘдҪңиҗҪеҲ°е®һеӨ„пјҢеҺҝеұҖеҸ¬ејҖдәҶеҢ»з–—еҷЁжў°дё“йЎ№ж•ҙжІ»е·ҘдҪңдјҡи®®пјҢдј иҫҫдәҶеёӮеұҖж–Ү件зІҫзҘһпјҢ并жҲҗз«ӢдәҶз”ұеұҖй•ҝд»»з»„й•ҝгҖҒеҲҶз®ЎеүҜеұҖй•ҝд»»еүҜз»„й•ҝгҖҒз»јеҗҲдёҡеҠЎиӮЎе…ЁдҪ“жҲҗе‘ҳеҸӮдёҺзҡ„дё“йЎ№ж•ҙжІ»е·ҘдҪңйўҶеҜје°Ҹз»„пјҢзЎ®дҝқдәҶиҝҷж¬Ўдё“йЎ№ж•ҙжІ»е·ҘдҪңзҡ„йЎәеҲ©иҝӣиЎҢгҖӮ
2гҖҒ жҳҺзЎ®зӣ®ж ҮпјҢзЎ®е®ҡдё“йЎ№ж•ҙжІ»е·ҘдҪңзҡ„иҢғеӣҙе’ҢйҮҚзӮ№
жң¬ж¬Ўдё“йЎ№ж•ҙжІ»е·ҘдҪңзҡ„йҮҚзӮ№иҢғеӣҙжҳҜеҢ»з–—еҷЁжў°дҪҝз”ЁеҚ•дҪҚе’ҢеҢ»з–—еҷЁжў°з»ҸиҗҘеҚ•дҪҚгҖӮеңЁжҲ‘еҺҝеҢ»з–—еҷЁжў°дҪҝз”ЁеҚ•дҪҚеҮ д№ҺеҢ…еҗ«дәҶе…ЁйғЁеҢ»з–—жңәжһ„пјҢиҖҢдё”дҪҝз”Ёе“Ғз§ҚеӨҡдёәдёҖж¬ЎжҖ§дҪҝз”Ёиҫ“ж¶ІеҷЁгҖҒжіЁе°„еҷЁпјҢиҖҢеҢ»з–—еҷЁжў°з»ҸиҗҘеҚ•дҪҚд»…жңү11家пјҢе…¶дёӯ7家дёәиҚҜе“Ғйӣ¶е”®дјҒдёҡпјҢ3家йҡҗжҖ§зңјй•ңз»ҸиҗҘдјҒдёҡпјҢ1家д№үйҪҝз»ҸиҗҘдјҒдёҡпјҢе…¶дёӯ7家йӣ¶е”®дјҒдёҡд№ҹд»…з»ҸиҗҘдёҖгҖҒдәҢзұ»еҷЁжў°пјҢз»ҸиҗҘе“Ғз§Қе°‘гҖӮеӣ жӯӨжң¬ж¬Ўдё“йЎ№ж•ҙжІ»зҡ„йҮҚзӮ№е°ұжҳҜеҢ»з–—еҷЁжў°дҪҝз”ЁеҚ•дҪҚпјҢеҠ ејәеҜ№иҝҷдәӣеҚ•дҪҚзҡ„зӣ‘зқЈжЈҖжҹҘжҳҜдҝқиҜҒеҢ»з–—еҷЁжў°дҪҝз”Ёе®үе…Ёжңүж•Ҳзҡ„ж №жң¬дҝқйҡңгҖӮ
дёүгҖҒеҠ ејәе®Јдј пјҢзЎ®дҝқдё“йЎ№ж•ҙжІ»е·ҘдҪңжңүжқЎдёҚзҙҠзҡ„иҝӣиЎҢ
1гҖҒз§ҜжһҒеҒҡеҘҪе®Јдј еҠЁе‘ҳе·ҘдҪңпјҢеҠӘеҠӣжҸҗй«ҳеҷЁжў°з»ҸиҗҘгҖҒдҪҝз”Ёдәәе‘ҳзҡ„жҖқжғіи®ӨиҜҶ
жҢүз…§е®үйЈҹиҚҜзӣ‘еҸ‘[2012]116еҸ·ж–Ү件дёӯе…ідәҺе®Јдј е·ҘдҪңзҡ„иҰҒжұӮпјҢжҲ‘еұҖеңЁж•ҙжІ»е·ҘдҪңзҡ„第дёҖйҳ¶ж®өз§ҜжһҒз»„з»Үдәәе‘ҳе°ұеҢ»з–—еҷЁжў°зҡ„иҙӯиҝӣгҖҒйӘҢ收гҖҒз»ҸиҗҘгҖҒдҪҝз”ЁгҖҒз”ЁеҗҺй”ҖжҜҒгҖҒзҙўиҜҒзҙўзҘЁзӯүж–№йқўеә”еҪ“жіЁж„ҸеҲ°зҡ„й—®йўҳеҗ‘зӣёеҜ№дәәз§ҜжһҒиҝӣиЎҢе®Јдј пјҢдҝғдҪҝз»ҸиҗҘдҪҝз”ЁеҚ•дҪҚд»ҺжҖқжғідёҠжҸҗй«ҳеҜ№е®үе…Ёз»ҸиҗҘгҖҒдҪҝз”ЁеҢ»з–—еҷЁжў°зҡ„и®ӨиҜҶпјҢд»ҺиҖҢдёәдё“йЎ№ж•ҙжІ»е·ҘдҪңйЎәеҲ©иҝӣиЎҢеҘ е®ҡеҹәзЎҖ
2гҖҒи®Өзңҹз»„з»Үиҫ–еҢәеҶ…еҢ»з–—еҷЁжў°з»ҸиҗҘгҖҒдҪҝз”ЁеҚ•дҪҚејҖеұ•иҮӘжҹҘиҮӘзә е·ҘдҪңпјҢзқҖйҮҚи§ЈеҶіе·ҘдҪңдёӯеӯҳеңЁзҡ„зӘҒеҮәй—®йўҳ
жҢүз…§еҢәеұҖдё“йЎ№ж•ҙжІ»е·ҘдҪңзҡ„иҰҒжұӮе’ҢжҲ‘еұҖеҜ№дё“йЎ№ж•ҙжІ»е·ҘдҪңзҡ„жҖ»дҪ“е®үжҺ’пјҢиҰҒжұӮиҫ–еҢәеҶ…зҡ„еҢ»з–—еҷЁжў°з»ҸиҗҘгҖҒдҪҝз”ЁеҚ•дҪҚеҜ№еҷЁжў°зҡ„иҙӯиҝӣжё йҒ“гҖҒйӘҢ收记еҪ•гҖҒй”Җе”®и®°еҪ•гҖҒй”ҖжҜҒи®°еҪ•гҖҒгҖҠеҢ»з–—еҷЁжў°з»ҸиҗҘи®ёеҸҜиҜҒгҖӢдёҠж ёеҮҶзҡ„з»ҸиҗҘиҢғеӣҙгҖҒжү§иЎҢеҢ»з–—еҷЁжў°дёҚиүҜдәӢ件зҡ„зӣ‘жөӢе’ҢжҠҘе‘ҠеҲ¶еәҰгҖҒиҙӯиҝӣеҢ»з–—еҷЁжў°зҙўиҰҒеҲ°зҡ„еҗҲж јиҜҒжҳҺд»ҘеҸҠд»Һдёҡдәәе‘ҳдҪ“жЈҖзӯүж–№йқўиҝӣиЎҢиҮӘжҹҘпјҢ并иҰҒжұӮеҗ„еҷЁжў°з»ҸиҗҘгҖҒдҪҝз”ЁеҚ•дҪҚеҜ№иҮӘжҹҘдёӯеҸ‘зҺ°зҡ„й—®йўҳдёҘж јжҢүзӣёе…іжі•и§„иҰҒжұӮж•ҙж”№еҲ°дҪҚпјҢзЎ®дҝқеҗ„иҮӘжүҖз»ҸиҗҘгҖҒдҪҝз”Ёзҡ„еҢ»з–—еҷЁжў°еҗҲжі•гҖҒе®үе…ЁгҖҒжңүж•ҲгҖӮ
3гҖҒе…ЁйқўиҝӣиЎҢзӣ‘зқЈжЈҖжҹҘпјҢдёҘеҺүжү“еҮ»еҢ»з–—еҷЁжў°з»ҸиҗҘгҖҒдҪҝз”ЁиҝҮзЁӢдёӯзҡ„иҝқжі•иЎҢдёәеңЁеҗ„еҢ»з–—еҷЁжў°з»ҸиҗҘгҖҒдҪҝз”ЁеҚ•дҪҚиҮӘжҹҘиҮӘзә зҡ„еҹәзЎҖдёҠпјҢеҺҝеұҖз»“еҗҲж—Ҙеёёзӣ‘зқЈжЈҖжҹҘе·ҘдҪңеҜ№иҫ–еҢәеҶ…еҢ»з–—еҷЁжў°з»ҸиҗҘгҖҒдҪҝз”ЁеҚ•дҪҚиҮӘжҹҘж•ҙж”№жғ…еҶөиҝӣиЎҢдәҶе…Ёйқўзҡ„зӣ‘зқЈжЈҖжҹҘгҖӮ
дёҖжҳҜеҜ№иҫ–еҢәеҢ»з–—еҷЁжў°з»ҸиҗҘдҪҝз”ЁеҚ•дҪҚзҡ„иҮӘжҹҘж•ҙж”№жғ…еҶөиҝӣиЎҢдәҶе…Ёйқўзҡ„зӣ‘зқЈжЈҖжҹҘпјҢеҜ№еңЁиҮӘжҹҘж•ҙж”№йҳ¶ж®өиғҪеӨҹиҮӘи§үйҮҮеҸ–жңүж•ҲжҺӘж–Ҫзә жӯЈжң¬еҚ•дҪҚеӯҳеңЁзӘҒеҮәй—®йўҳзҡ„пјҢдёҖеҫӢдёҚиҝҪ究其法еҫӢиҙЈд»»пјӣдәҢжҳҜеҜ№жң¬еҚ•дҪҚеӯҳеңЁзҡ„й—®йўҳжңӘиҮӘжҹҘеҲ°дҪҚпјҢжү§жі•дәәе‘ҳеңЁзӣ‘зқЈжЈҖжҹҘиҝҮзЁӢдёӯйғҪжҢүзӣёе…іжі•еҫӢ法规дёӢеҸ‘дәҶж•ҙж”№ж„Ҹи§ҒпјӣдёүжҳҜеҜ№дёӘеҲ«еҢ»з–—жңәжһ„дҪҝз”ЁдёҖж¬ЎжҖ§ж— иҸҢеҢ»з–—еҷЁжў°еҗҺдёҚиҝӣиЎҢеҸҠж—¶жҜҒеҪўгҖҒй”ҖжҜҒ并е»әз«Ӣи®°еҪ•зҡ„иЎҢдёәеҸҠж—¶еҸҚйҰҲз»ҷеҚ«з”ҹйғЁй—ЁеӨ„зҗҶпјӣеӣӣжҳҜеҜ№еҗ„еҢ»з–—жңәжһ„еҢ–йӘҢе®ӨиҝӣиЎҢдәҶдёҖж¬ЎеҪ»еә•зҡ„жё…зҗҶжЈҖжҹҘпјҢеҜ№еӯҳеңЁзҡ„зӘҒеҮәй—®йўҳжҸҗеҮәдәҶж•ҙж”№ж„Ҹи§Ғ并еҗ‘з®ЎзҗҶзӣёеҜ№дәәиҝӣиЎҢеҸҚйҰҲпјӣ
жң¬ж¬Ўдё“йЎ№ж•ҙжІ»пјҢе…ұзӣ‘зқЈжЈҖжҹҘеҢ»з–—еҷЁжў°з»ҸиҗҘгҖҒдҪҝз”ЁеҚ•дҪҚ200дҪҷ家次пјҢжЈҖжҹҘиҰҶзӣ–зҺҮиҫҫеҲ°дәҶ100%гҖӮгҖӮ
дёүгҖҒеӯҳеңЁзҡ„й—®йўҳеҸҠд»ҠеҗҺзҡ„е·ҘдҪңжҖқи·Ҝ
пјҲдёҖпјүеӯҳеңЁзҡ„й—®йўҳ
1гҖҒиҙӯиҝӣйӘҢ收зҺҜиҠӮеӯҳеңЁзҡ„й—®йўҳиҝҳжҜ”иҫғеӨҡгҖӮ
еҗ„еҢ»з–—жңәжһ„е’ҢеҢ»з–—еҷЁжў°з»ҸиҗҘеҚ•дҪҚеңЁиҙӯиҝӣеҢ»з–—еҷЁжў°ж—¶дёҚжіЁж„ҸжҹҘйӘҢеҜ№ж–№зҡ„иө„иҙЁиҜҒжҳҺпјҢеҸӘжҳҜд№үеҠЎжҖ§зҡ„зҙўиҰҒдәҶдҫӣиҙ§ж–№зҡ„гҖҠеҢ»з–—еҷЁжў°з»ҸиҗҘи®ёеҸҜиҜҒгҖӢжҲ–гҖҠеҢ»з–—еҷЁжў°з”ҹдә§и®ёеҸҜиҜҒгҖӢгҖҒдә§е“ҒжіЁеҶҢиҜҒе’ҢеҗҲж јиҜҒжҳҺпјҢиҖҢжІЎжңүеҜ№иҝҷдәӣиҜҒз…§иҝӣиЎҢиҜҰз»Ҷзҡ„е®ЎйӘҢпјҢеҜјиҮҙе®һзү©дёҺиҜҒз…§дёҚз¬ҰгҖӮ
2гҖҒжІЎжңүеҚ•зӢ¬зҡ„еҢ»з–—еҷЁжў°д»“еә“е’ҢеҢ»з–—еҷЁжў°йҷҲеҲ—еҢәгҖӮ
еңЁжЈҖжҹҘдёӯеҸ‘зҺ°пјҢйҷӨеҢ»з–—еҷЁжў°з»ҸиҗҘеҚ•дҪҚжңүеӣәе®ҡзҡ„еҚ•зӢ¬еҢ»з–—еҷЁжў°дё“жҹңеӨ–пјҢеӨ§еӨҡеҢ»з–—еҷЁжў°дҪҝз”ЁеҚ•дҪҚйғҪжІЎжңүеҚ•зӢ¬зҡ„еҢ»з–—еҷЁжў°д»“еә“пјҢеҢ»з–—еҷЁжў°дёҖиҲ¬йғҪж”ҫеңЁиҚҜжҲҝдёӯпјҢдё”жІЎжҳҺжҳҫж Үеҝ—гҖӮ
3гҖҒдёҖж¬ЎжҖ§дҪҝз”Ёж— иҸҢеҢ»з–—еҷЁжў°й”ҖжҜҒи®°еҪ•дёҚ规иҢғгҖӮ
еңЁжЈҖжҹҘдёӯеҸ‘зҺ°пјҢйҷӨд№Ўй•ҮеҚ«з”ҹйҷўе’ҢйғЁеҲҶжқ‘еҚ«з”ҹе®Өе»әжңүй”ҖжҜҒи®°еҪ•еӨ–пјҢеӨ§еӨҡдёӘдҪ“иҜҠжүҖйғҪжІЎжңүе»әз«Ӣй”ҖжҜҒи®°еҪ•пјҢдё”е»әз«Ӣзҡ„и®°еҪ•еҸӘеҶҷжҳҺдәҶй”ҖжҜҒзҡ„е…·дҪ“ж•°йҮҸпјҢиҖҢеҜ№е…¶д»–еҶ…е®№еҸӘеӯ—дёҚжҸҗгҖӮ
4гҖҒеҢ»з–—еҷЁжў°е»әжЎЈиө„ж–ҷдёҚе…ЁгҖӮ
жҲ‘еҺҝеӨ§дёӯеһӢеҢ»з–—еҷЁжў°дҪҝз”ЁеҚ•дҪҚдё»иҰҒжҳҜеҗ„зә§еҢ»з–—еҚ«з”ҹжңәжһ„пјҢиҖҢдё”жүҖз”ЁеҷЁжў°еҮ д№Һе…ЁйғЁжҳҜдёҠзә§йғЁй—Ёй…ҚеҸ‘зҡ„пјҢиҮӘиЎҢйҮҮиҙӯзҡ„иҫғе°‘пјҢиҖҢдёҠзә§й…ҚеҸ‘зҡ„иҝҷдәӣеӨ§еһӢеҢ»з–—еҷЁжў°д»…жңүдә§е“Ғзҡ„дҪҝз”ЁиҜҙжҳҺд№ҰпјҢе…¶д»–еҰӮиҙӯиҝӣзҘЁжҚ®гҖҒиө„иҙЁиҜҒжҳҺж–Ү件зӯүиө„ж–ҷзјәеӨұпјҢеӣ жӯӨеӨҡж•°еҢ»з–—жңәжһ„йғҪдёҚзҹҘйҒ“жүҖз”ЁеҷЁжў°зҡ„иҜҰз»ҶдҝЎжҒҜпјҢйҖ жҲҗжүҖз”ЁеҷЁжў°зҡ„жЎЈжЎҲиө„ж–ҷдёҚе…ЁгҖӮ
5гҖҒеҢ»з–—еҷЁжў°з»ҸиҗҘгҖҒдҪҝз”Ёдәәе‘ҳжі•еҫӢж„ҸиҜҶж·Ўи–„пјҢеҜ№еҢ»з–—еҷЁжў°зҡ„йҮҚи§ҶзЁӢеәҰдёҚеӨҹгҖӮ
з”ұдәҺиҚҜжў°д»Һдёҡдәәе‘ҳжөҒеҠЁжҖ§еӨ§пјҢдҪҝеҫ—дёҖйғЁеҲҶеҲҡеҲҡиҝӣе…ҘиҜҘиЎҢдёҡдәәе‘ҳеҜ№еҢ»з–—еҷЁжў°ж–№йқўзҡ„жі•еҫӢ法规没жңүз»ҸиҝҮдё“й—Ёеҹ№и®ӯпјҢеӣ жӯӨйҖ жҲҗдәҶиҝқ规问йўҳз»ҸеёёеҮәзҺ°гҖӮ
пјҲдәҢпјүд»ҠеҗҺе·ҘдҪңжҖқи·Ҝ
1гҖҒй’ҲеҜ№еӯҳеңЁзҡ„й—®йўҳпјҢеҠ еӨ§ж—Ҙеёёзӣ‘зқЈжЈҖжҹҘе·ҘдҪңеҠӣеәҰгҖӮзӘҒеҮәйҮҚзӮ№пјҢдёҘж јжү§жі•жЈҖжҹҘпјҢжҠҠеҢ»з–—еҷЁжў°зҡ„ж—Ҙеёёзӣ‘зқЈз®ЎзҗҶе’ҢиҚҜе“Ғж—Ҙеёёзӣ‘зқЈз®ЎзҗҶе·ҘдҪңз»“еҗҲиө·жқҘиҝӣиЎҢпјҢд»ҺйҮҚд»ҺдёҘеҜ№дёҖдәӣдёҚиғҪжҢү照规е®ҡз»ҸиҗҘгҖҒдҪҝз”ЁеҢ»з–—еҷЁжў°зҡ„еҚ•дҪҚе’ҢдёӘдәәиҝӣиЎҢеӨ„зҗҶпјҢеҠӘеҠӣдҪҝжҲ‘еҺҝеҢ»з–—еҷЁжў°еёӮеңәд»Һж №жң¬дёҠеҫ—еҲ°еҘҪиҪ¬гҖӮ
2гҖҒеҠ еӨ§е®Јдј еҹ№и®ӯеҠӣеәҰпјҢжҸҗй«ҳеҢ»з–—еҷЁжў°з»ҸиҗҘгҖҒдҪҝз”ЁиҖ…зҡ„зҙ иҙЁгҖӮеңЁд»ҘеҗҺзҡ„е·ҘдҪңдёӯжҲ‘们иҰҒеҠ еӨ§еҜ№еҢ»з–—еҷЁжў°зӣёе…іжі•еҫӢ法规зҹҘиҜҶзҡ„е®Јдј е’Ңеҹ№и®ӯеҠӣеәҰпјҢдҪҝ他们иғҪеӨҹеҸҠж—¶дәҶи§Је’ҢжҺҢжҸЎеӣҪ家еңЁеҢ»з–—еҷЁжў°ж–№йқўзҡ„зӣёе…іи§„е®ҡпјҢд»ҺиҖҢжҸҗй«ҳеҢ»з–—еҷЁжў°з»ҸиҗҘгҖҒдҪҝз”ЁиҖ…зҡ„иғҪеҠӣе’Ңж°ҙе№ігҖӮ
3гҖҒз§ҜжһҒејҖеұ•и°ғжҹҘз ”з©¶пјҢжҺўзҙўеҢ»з–—еҷЁжў°зӣ‘з®Ўе·ҘдҪңзҡ„й•ҝж•ҲжңәеҲ¶гҖӮеҢ»з–—еҷЁжў°зҡ„зӣ‘з®ЎжҳҜдёҖйЎ№дё“дёҡжҖ§еҫҲејәзҡ„е·ҘдҪңпјҢеӣ е…¶е“Ғз§ҚеӨҡпјҢжҖ§иғҪеӨҚжқӮпјҢз»ҸиҗҘдҪҝз”Ёе…·жңүзү№е®ҡзҡ„дё“дёҡжҖ§пјҢеӣ жӯӨпјҢеңЁж—Ҙеёёзӣ‘з®Ўе·ҘдҪңдёӯз§ҜжһҒејҖеұ•и°ғз ”е·ҘдҪңпјҢжҺўзҙўе’ҢеҜ»жұӮ科еӯҰзҡ„зӣ‘з®Ўж–№жі•гҖӮ
зҜҮдәҢ:дёүжҳҜзӘҒеҮәйҮҚзӮ№,иҰҶзӣ–е…ЁйқўгҖӮз»“еҗҲе…·дҪ“еҢ»з–—еҷЁжў°жҠҪжЈҖе“Ғз§Қе’ҢжҲ‘иҫ–еҢәе®һйҷ…жғ…еҶө,гҖӮ
еҢ»з–—еҷЁжў°жі•и§„дёҺеёӮеңәзӣ‘з®Ў
еҢ»з–—еҷЁжў°жі•и§„дёҺеёӮеңәзӣ‘з®Ў
------- е®үеҫҪзңҒйЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎеұҖ зҺӢеЈ°еҸ‘
дёҖгҖҒеҢ»з–—еҷЁжў°еҹәжң¬жҰӮиҝ°
(дёҖ)еҢ»з–—еҷЁжў°е®ҡд№ү
20дё–зәӘ80е№ҙд»ЈпјҢеӣҪйҷ…ж ҮеҮҶеҢ–з»„з»ҮеңЁеҲ¶е®ҡ并еҸ‘еёғзҡ„еҢ»з–—еҷЁжў°иҙЁйҮҸз®ЎзҗҶж ҮеҮҶеҸҠзӣёе…іж ҮеҮҶдёӯеҜ№еҢ»з–—еҷЁжў°дҪңдәҶе®ҡд№үгҖӮжҲ‘еӣҪеңЁ2000е№ҙ4жңҲ1ж—ҘйўҒеёғж–ҪиЎҢеҸҠ2014е№ҙ6жңҲ1ж—Ҙдҝ®и®ўж–ҪиЎҢгҖҠеҢ»з–—еҷЁжў°зӣ‘зқЈз®ЎзҗҶжқЎдҫӢгҖӢеҜ№еҢ»з–—еҷЁжў°е®ҡд№үдёәпјҡеҢ»з–—еҷЁжў°жҳҜжҢҮзӣҙжҺҘжҲ–иҖ…й—ҙжҺҘз”ЁдәҺдәәдҪ“зҡ„д»ӘеҷЁгҖҒи®ҫеӨҮгҖҒеҷЁе…·гҖҒдҪ“еӨ–иҜҠж–ӯиҜ•еүӮеҸҠж ЎеҮҶзү©гҖҒжқҗж–ҷд»ҘеҸҠе…¶д»–зұ»дјјжҲ–иҖ…зӣёе…ізҡ„зү©е“ҒпјҢеҢ…жӢ¬жүҖйңҖиҰҒзҡ„и®Ўз®—жңәиҪҜ件пјӣе…¶ж•Ҳз”Ёдё»иҰҒйҖҡиҝҮзү©зҗҶзӯүж–№ејҸиҺ·еҫ—пјҢдёҚжҳҜйҖҡиҝҮиҚҜзҗҶеӯҰгҖҒе…Қз–«еӯҰжҲ–иҖ…д»Ји°ўзҡ„ж–№ејҸиҺ·еҫ—пјҢжҲ–иҖ…иҷҪ然жңүиҝҷдәӣж–№ејҸеҸӮдёҺ
дҪҶжҳҜеҸӘиө·иҫ…еҠ©дҪңз”Ёпјӣе…¶зӣ®зҡ„жҳҜпјҡ1гҖҒз–ҫз—…зҡ„иҜҠж–ӯгҖҒйў„йҳІгҖҒзӣ‘жҠӨгҖҒжІ»з–—жҲ–иҖ…зј“и§Јпјӣ
2гҖҒжҚҹдјӨзҡ„иҜҠж–ӯгҖҒзӣ‘жҠӨгҖҒжІ»з–—гҖҒзј“и§ЈжҲ–иҖ…еҠҹиғҪиЎҘеҒҝпјӣ3гҖҒгҖҒз”ҹзҗҶз»“жһ„жҲ–иҖ…з”ҹзҗҶиҝҮзЁӢзҡ„жЈҖйӘҢгҖҒжӣҝд»ЈгҖҒи°ғиҠӮжҲ–иҖ…ж”ҜжҢҒпјӣ4гҖҒз”ҹе‘Ҫзҡ„ж”ҜжҢҒжҲ–иҖ…з»ҙжҢҒпјӣ5гҖҒеҰҠеЁ жҺ§еҲ¶пјӣ6гҖҒйҖҡиҝҮеҜ№жқҘиҮӘдәәдҪ“зҡ„ж ·жң¬иҝӣиЎҢжЈҖжҹҘпјҢдёәеҢ»з–—жҲ–иҖ…иҜҠж–ӯзӣ®зҡ„жҸҗдҫӣдҝЎжҒҜгҖӮ
еҰӮдҪ•еҲӨж–ӯжҹҗдёӘдә§е“ҒжҳҜеҗҰеұһдәҺеҢ»з–—еҷЁжў°пјҢеҸҜжіЁж„Ҹдә”дёӘиҰҒзӮ№пјҡ1гҖҒжҳҜеҗҰз”ЁдәҺдәәдҪ“пјҲзҫҺеӣҪзҡ„еҢ»з–—еҷЁжў°е®ҡд№үдёӯйў„жңҹдҪҝз”ЁеҢ…еҗ«дәҶеҠЁзү©е’Ңдәәзұ»пјүпјӣ2гҖҒжҳҜеҗҰз¬ҰеҗҲе®ҡд№үжүҖ规е®ҡзҡ„6дёӘйў„жңҹз”ЁйҖ”д№ӢдёҖпјӣ3пјҺжҳҜеҗҰжңүзҗҶи®әдҫқжҚ®пјҢж”ҜжҢҒиҫҫеҲ°йў„жңҹзҡ„ж•ҲжһңпјҲжҲ‘еӣҪзҡ„дёӯеҢ»зҗҶи®әпјҢзӣ®еүҚиҝҳжңӘиў«жүҖжңүеӣҪ家жүҖжҷ®йҒҚжҺҘеҸ—пјүпјӣ4пјҺжҳҜеҗҰжңүдёҙеәҠйӘҢиҜҒпјӣ5пјҺжҳҜжҳҜжңүиҚҜзү©жҲ–д»Ји°ўжҲ–е…Қз–«еңЁиө·дё»иҰҒдҪңз”ЁгҖӮз¬ҰеҗҲд»ҘдёҠдә”зӮ№иҰҒжұӮпјҢйҖҡеёёеҸҜз§°д№ӢдёәеҢ»з–—еҷЁжў°гҖӮ
дҪҶжҳҜйҡҸзқҖз”ҹзү©еҢ»еӯҰе·ҘзЁӢзҡ„еҝ«йҖҹеҸ‘еұ•пјҢжңүдәӣдә§е“Ғиҫғйҡҫз•Ңе®ҡпјҢеҰӮзӣ®еүҚиҚҜжў°з»“еҗҲпјҲз»„еҗҲдә§е“Ғпјүдә§е“Ғи¶ҠжқҘи¶ҠеӨҡпјҢд№ҹжҳҜеҢ»з–—еҷЁжў°еҸ‘еұ•зҡ„дёҖдёӘж–№еҗ‘пјҢеҜ№иҜҘзұ»дә§е“Ғзҡ„е®ҡдҪҚжҳҜиҚҜиҝҳжҳҜеҢ»з–—еҷЁжў°д№ҹи¶ҠжқҘи¶ҠеҖјеҫ—з ”з©¶пјҢе®һиЎҢеҸҢйҮҚз®ЎзҗҶзҡ„жЁЎејҸеә”жҳҜдёҖдёӘи¶ӢеҠҝгҖӮ
пјҲдәҢпјүеҢ»з–—еҷЁжў°еҲҶзұ»
гҖҠжқЎдҫӢгҖӢ第еӣӣжқЎ:еӣҪ家еҜ№еҢ»з–—еҷЁжў°жҢүз…§йЈҺйҷ©зЁӢеәҰе®һиЎҢеҲҶзұ»з®ЎзҗҶгҖӮ第дёҖзұ»жҳҜйЈҺйҷ©зЁӢеәҰдҪҺпјҢе®һиЎҢ常规管зҗҶеҸҜд»ҘдҝқиҜҒе…¶е®үе…ЁгҖҒжңүж•Ҳзҡ„еҢ»з–—еҷЁжў°гҖӮ第дәҢзұ»жҳҜе…·жңүдёӯеәҰйЈҺйҷ©пјҢйңҖиҰҒдёҘж јжҺ§еҲ¶з®ЎзҗҶд»ҘдҝқиҜҒе…¶е®үе…ЁгҖҒжңүж•Ҳзҡ„еҢ»з–—еҷЁжў°гҖӮ第дёүзұ»жҳҜе…·жңүиҫғй«ҳйЈҺ
йҷ©пјҢйңҖиҰҒйҮҮеҸ–зү№еҲ«жҺӘж–ҪдёҘж јжҺ§еҲ¶з®ЎзҗҶд»ҘдҝқиҜҒе…¶е®үе…ЁгҖҒжңүж•Ҳзҡ„еҢ»з–—еҷЁжў°гҖӮиҜ„д»·еҢ»з–—еҷЁжў°йЈҺйҷ©зЁӢеәҰпјҢеә”еҪ“иҖғиҷ‘еҢ»з–—еҷЁжў°зҡ„йў„жңҹзӣ®зҡ„гҖҒз»“жһ„зү№еҫҒгҖҒдҪҝз”Ёж–№жі•зӯүеӣ зҙ гҖӮ еҢ»з–—еҷЁжў°е…¶е®ғеҲҶзұ»пјҡ1гҖҒжҢүз»“жһ„зү№еҫҒеҲҶпјҡжңүжәҗеҢ»з–—еҷЁжў°е’Ңж— жәҗеҢ»з–—еҷЁжў°пјӣ
2гҖҒжҢүдҪҝз”ЁеҪўејҸеҲҶпјҡпјҲ1пјүжңүжәҗзҡ„дҪҝз”ЁеҪўејҸжңүпјҡиғҪйҮҸжІ»з–—гҖҒиҜҠж–ӯзӣ‘жҠӨгҖҒиҫ“йҖҒдҪ“ ж¶ІеҢ»з–—зӯүеҸҠе…¶д»–жңүжәҗжҲ–жңүжәҗиҫ…еҠ©и®ҫеӨҮзӯүпјӣпјҲ2пјүж— жәҗзҡ„дҪҝз”ЁеҪўејҸжңүпјҡиҚҜж¶Іиҫ“йҖҒдҝқеӯҳгҖҒж”№еҸҳиЎҖж¶ІжҲ–дҪ“ж¶ІеҷЁжў°гҖҒжӨҚе…ҘеҷЁжў°зӯүеҸҠе…¶д»–ж— жәҗжҺҘи§Ұиҫ…еҠ©еҷЁжў°зӯүпјӣгҖҗдёүжҳҜзӘҒеҮәйҮҚзӮ№,иҰҶзӣ–е…ЁйқўгҖӮз»“еҗҲе…·дҪ“еҢ»з–—еҷЁжў°жҠҪжЈҖе“Ғз§Қе’ҢжҲ‘иҫ–еҢәе®һйҷ…жғ…еҶө,гҖӮгҖ‘
3гҖҒжҢүдҪҝз”ЁзҠ¶еҶөеҲҶпјҡжҺҘи§ҰжҲ–иҝӣе…ҘдәәдҪ“еҷЁжў°пјӣйқһжҺҘи§ҰдәәдҪ“еҷЁжў°гҖӮ
4гҖҒеҢ»з–—еҷЁжў°дё»иҰҒз”ЁдәҺеҢ»з–—жңәжһ„пјҲдҪҝз”ЁеҚ•дҪҚпјүпјҢдҪҝз”ЁеҚ•дҪҚйҖҡеёёж №жҚ®еҢ»з–—еҷЁжў°зҡ„дҪҝз”Ёзү№зӮ№еҲҶдёәпјҡд»ӘеҷЁи®ҫеӨҮзұ»гҖҒеҷЁе…·зұ»е’ҢеҚ«з”ҹжқҗж–ҷзұ»пјҢе…¶дёӯеҷЁе…·зұ»е’Ңжқҗж–ҷзұ»жҳҜж¶ҲиҖ—жҖ§еҢ»з–—з”Ёе“ҒпјҢиҖҢд»ӘеҷЁи®ҫеӨҮзұ»жҳҜзәіе…ҘеҢ»з–—жңәжһ„еӣәе®ҡиө„дә§з®ЎзҗҶгҖӮ
пјҲдёүпјүеҢ»з–—еҷЁжў°еҲҶзұ»и§„еҲҷ
еӣҪ家йЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶжҖ»еұҖж №жҚ®гҖҠжқЎдҫӢгҖӢпјҢе…ҲеҗҺеҲ¶е®ҡгҖҠеҢ»з–—еҷЁжў°еҲҶзұ»и§„еҲҷгҖӢпјҢ з”ЁдәҺжҢҮеҜјгҖҠеҢ»з–—еҷЁжў°еҲҶзұ»зӣ®еҪ•гҖӢзҡ„еҲ¶е®ҡе’ҢзЎ®е®ҡж–°зҡ„дә§е“ҒжіЁеҶҢзұ»еҲ«гҖӮзӣ®еүҚе…ұжңү43дёӘдёҖзә§зұ»еҲ«е’Ң260дёӘдәҢзә§зұ»еҲ«зҡ„дә§е“Ғз§Қзұ»пјҢеҸҰеӨ–иҝҳжңүжҢүеҢ»з–—еҷЁжў°з®ЎзҗҶзҡ„дҪ“еӨ–иҜҠж–ӯиҜ•еүӮдә§е“ҒгҖӮеҢ»з–—еҷЁжў°дә§е“ҒйҖҡз”Ёзј–з Ғдёә68пјҢеҰӮ6840дёҙеәҠжЈҖйӘҢеҲҶжһҗд»ӘеҷЁпјҲдёҖзә§зұ»еҲ«зј–з ҒеҗҚз§°пјүеҗ«9дёӘдәҢзә§зұ»еҲ«еӯҗзј–з ҒгҖӮ
дәҢгҖҒеҢ»з–—еҷЁжў°зӣ‘з®ЎдҪ“зі»
пјҲдёҖпјүзӣ‘з®ЎдҪ“еҲ¶
жҲ‘еӣҪзҺ°иЎҢзҡ„еҢ»з–—еҷЁжў°зӣ‘з®Ўжңәжһ„пјҡеӣҪ家жҖ»еұҖгҖҒзңҒгҖҒеёӮгҖҒеҺҝйЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎеұҖеҢ»з–—еҷЁжў°иЎҢж”ҝзӣ‘з®®жңәжһ„пјҢд»ҘеҸҠжүҖеұһзҡ„жҠҖжңҜе®ЎиҜ„гҖҒжЈҖйӘҢгҖҒзӣ‘жөӢдёҺеҶҚиҜ„д»·зӯүжҠҖжңҜзӣ‘зқЈжңәжһ„гҖӮ
иЎҢж”ҝе®Ўжү№иҒҢиғҪпјҡ1гҖҒеӣҪ家еұҖе®Ўжү№иҝӣеҸЈеҢ»з–—еҷЁжў°гҖҒдёүзұ»еҢ»з–—еҷЁжў°дә§е“ҒжіЁеҶҢгҖӮ2гҖҒзңҒеұҖе®Ўжү№еҢ»з–—еҷЁжў°з”ҹдә§и®ёеҸҜгҖҒиҙЁйҮҸдҪ“зі»и®ӨиҜҒпјҢдәҢзұ»еҢ»з–—еҷЁжў°дә§е“ҒжіЁеҶҢгҖӮ3гҖҒеёӮеұҖеҸҠзңҒзӣҙз®ЎеҺҝеұҖе®Ўжү№з»ҸиҗҘи®ёеҸҜиҜҒпјҲдәҢзұ»еӨҮжЎҲпјүгҖҒдёҖзұ»еҢ»з–—еҷЁжў°дә§е“ҒеӨҮжЎҲгҖӮ
пјҲдәҢпјүзӣ‘з®ЎжҺӘж–Ҫ
иЎҢж”ҝжҖ§зҡ„жҺӘж–Ҫпјҡ1гҖҒеҲ¶е®ҡеӣҪ家е’ҢиЎҢдёҡзҡ„ејәеҲ¶жҖ§ж ҮеҮҶе’ҢжҺЁиҚҗж ҮеҮҶпјӣ2гҖҒеҜ№з”ҹдә§дјҒдёҡиҝӣиЎҢзҺ°еңәжЈҖжҹҘе’Ңж—Ҙеёёзӣ‘зқЈпјӣ3гҖҒеҜ№еҢ»з–—еҷЁжў°еёӮеңәе®һж–Ҫзӣ‘зқЈжҠҪжҹҘпјӣ4гҖҒеҲ¶е®ҡеҢ»з–—еҷЁжў°еҲҶзұ»з®ЎзҗҶ规еҲҷпјҢе®һж–ҪеҲҶзә§з®ЎзҗҶпјӣ5гҖҒе®һж–ҪеҜ№еҢ»з–—еҷЁжў°дёҠеёӮеүҚзҡ„жҠҖжңҜе®ЎжҹҘе’ҢжіЁеҶҢе®Ўжү№пјӣ6гҖҒе®һж–ҪеҜ№з”ҹдә§дјҒдёҡиҙЁйҮҸдҪ“зі»зҡ„ејәеҲ¶жҖ§и®ӨеҸҜпјӣ7гҖҒе®һж–ҪеҢ»з–—еҷЁжў°еёӮеңәзҡ„з»јеҗҲ
зӣ‘зқЈпјӣ8гҖҒе®һж–ҪеҢ»з–—еҷЁжў°зҡ„е№ҝе‘Ҡе®ЎжҹҘе’Ңе®Ўжү№пјӣ9гҖҒеҜ№еҢ»з–—еҷЁжў°е®һж–ҪдёҚиүҜеҸҚеә”зҡ„и·ҹиёӘжЈҖжҹҘе’ҢйҖҡжҠҘпјӣ10гҖҒејҖеұ•еҸ¬еӣһгҖҒеҶҚиҜ„д»·пјҢе®һж–ҪеҢ»з–—ж·ҳжұ°еҲ¶еәҰгҖӮ
жҠҖжңҜжҖ§зҡ„жҺӘж–Ҫпјҡ1гҖҒејҖеұ•жҠҖжңҜжҖ§зҡ„йӘҢиҜҒпјҢиө·иҚүе…·дҪ“дә§е“Ғзҡ„ж ҮеҮҶпјӣ2гҖҒй’ҲеҜ№е…·жңүе…ұжҖ§е’ҢйҖҡз”ЁжҖ§зҡ„жҠҖжңҜиҜҫйўҳеұ•ејҖз ”з©¶пјӣ3гҖҒдҫқжҚ®зӣёе…ізҡ„ж ҮеҮҶејҖеұ•дә§е“Ғзҡ„жЈҖжөӢпјӣ4гҖҒе®һж–ҪеҢ»з–—еҷЁжў°дә§е“ҒеҠЁзү©е®һйӘҢпјӣ5гҖҒе®һж–ҪеҢ»з–—еҷЁжў°зҡ„дёҙеәҠе®һйӘҢпјӣ6гҖҒеҜ№дёҠеёӮеүҚзҡ„еҢ»з–—еҷЁжў°иҝӣиЎҢз»јеҗҲжҖ§зҡ„жҠҖжңҜиҜ„д»·пјӣ7гҖҒеҜ№ејҖеұ•иҙЁйҮҸдҝқиҜҒдҪ“зі»зҡ„з”ҹдә§дјҒдёҡиҝӣиЎҢзҺ°еңәдҪ“зі»жЈҖжҹҘпјӣ8гҖҒејҖеұ•еҢ»з–—еҷЁжў°дёҚиүҜдәӢ件и·ҹиёӘзӣ‘жөӢе’ҢеҶҚиҜ„д»·гҖӮ
пјҲдёүпјүзӣ‘管法规
еҢ»з–—еҷЁжў°зӣ‘з®Ўзҡ„дҫқжҚ®гҖҠеҢ»з–—еҷЁжў°зӣ‘зқЈз®ЎзҗҶжқЎдҫӢгҖӢпјҢе…¶дёӯ第дәҢжқЎвҖңеңЁдёӯеҚҺдәәж°‘е…ұе’ҢеӣҪеўғеҶ…д»ҺдәӢеҢ»з–—еҷЁжў°зҡ„з ”еҲ¶гҖҒз”ҹдә§гҖҒз»ҸиҗҘгҖҒдҪҝз”Ёжҙ»еҠЁеҸҠе…¶зӣ‘зқЈз®ЎзҗҶпјҢеә”еҪ“йҒөе®Ҳжң¬жқЎдҫӢвҖқпјӣ第дёүжқЎвҖңеӣҪеҠЎйҷўйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶйғЁй—ЁиҙҹиҙЈе…ЁеӣҪеҢ»з–—еҷЁжў°зӣ‘зқЈз®ЎзҗҶе·ҘдҪңгҖӮеӣҪеҠЎйҷўжңүе…ійғЁй—ЁеңЁеҗ„иҮӘзҡ„иҒҢиҙЈиҢғеӣҙеҶ…иҙҹиҙЈдёҺеҢ»з–—еҷЁжў°жңүе…ізҡ„зӣ‘зқЈз®ЎзҗҶе·ҘдҪңгҖӮеҺҝзә§д»ҘдёҠең°ж–№дәәж°‘ж”ҝеәңйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶйғЁй—ЁиҙҹиҙЈжң¬иЎҢж”ҝеҢәеҹҹзҡ„еҢ»з–—еҷЁжў°зӣ‘зқЈз®ЎзҗҶе·ҘдҪңгҖӮеҺҝзә§д»ҘдёҠең°ж–№дәәж°‘ж”ҝеәңжңүе…ійғЁй—ЁеңЁеҗ„иҮӘзҡ„иҒҢиҙЈиҢғеӣҙеҶ…иҙҹиҙЈдёҺеҢ»з–—еҷЁжў°жңүе…ізҡ„зӣ‘зқЈз®ЎзҗҶе·ҘдҪңгҖӮвҖқ
ж–°дҝ®и®ўзҡ„гҖҠеҢ»з–—еҷЁжў°зӣ‘зқЈз®ЎзҗҶжқЎдҫӢгҖӢпјҲ2014е№ҙ6жңҲ1ж—Ҙж–ҪиЎҢпјүпјҢдёҺж—§жқЎдҫӢзӣёжҜ”пјҡ1гҖҒжҖқи·ҜдёҠпјҡдёҖжҳҜд»ҘеҲҶзұ»з®ЎзҗҶдёәеҹәзЎҖпјҢзӘҒеҮәз®ЎзҗҶзҡ„科еӯҰжҖ§пјӣдәҢжҳҜд»ҘйЈҺйҷ©й«ҳдҪҺдёәдҫқжҚ®пјҢзӘҒеҮәз”Ёжў°зҡ„е®үе…ЁжҖ§пјӣдёүжҳҜдјҒдёҡз®ЎзҗҶе®ҪдёҘзӣёжөҺпјҢдҪ“зҺ°еёӮеңә规еҫӢжҖ§пјӣеӣӣжҳҜеҮҸе°‘дәӢеүҚе®Ўжү№и®ёеҸҜпјҢжҸҗй«ҳзӣ‘з®Ўжңүж•ҲжҖ§гҖӮ
2гҖҒжҖ»дҪ“дёҠпјҡзӘҒеҮәйЈҺйҷ©з®ЎзҗҶгҖҒе…ЁзЁӢзӣ‘з®ЎгҖҒиҗҪе®һдјҒдёҡдё»дҪ“иҙЈд»»гҖӮ
3гҖҒе…·дҪ“дёҠпјҡдёҖжҳҜе®Ңе–„еҲҶзұ»з®ЎзҗҶпјҡдҪ“зҺ°вҖңй«ҳйЈҺйҷ©дә§е“Ғй«ҳй—Ёж§ӣпјҢдҪҺйЈҺйҷ©дә§е“Ғз®ҖеҢ–еҮҶе…ҘжүӢз»ӯвҖқпјӣдәҢжҳҜејәеҢ–иҝҮзЁӢзӣ‘з®Ўе’Ңж—Ҙеёёзӣ‘з®ЎпјӣдёүжҳҜжҳҺзЎ®еҢ»з–—еҷЁжў°дёҚиүҜдәӢ件зӣ‘жөӢгҖҒеҶҚиҜ„д»·гҖҒеҸ¬еӣһзӯүдёҠеёӮеҗҺзӣ‘з®ЎеҲ¶еәҰпјӣеӣӣжҳҜжҸҗй«ҳеӨ„зҪҡе№…еәҰгҖҒеҠ еӨ§еӨ„зҪҡеҠӣеәҰ
4гҖҒеҪўејҸдёҠпјҡж—§гҖҠжқЎдҫӢгҖӢ6з« 48жқЎпјҢж–°гҖҠжқЎдҫӢгҖӢ8з« 80жқЎпјҢе…¶зү№зӮ№пјҡдёҖжҳҜеҲҶи®ҫвҖңеҢ»з–—еҷЁжў°жіЁеҶҢдёҺеӨҮжЎҲвҖқз« иҠӮпјҢж¶үеҸҠеҢ»з–—еҷЁжў°жіЁеҶҢжқЎж¬ҫжңү11жқЎгҖҒж¶үеҸҠеҢ»з–—еҷЁжў°еӨҮжЎҲзҡ„жқЎж¬ҫжңү4жқЎпјӣдәҢжҳҜеҲҶи®ҫвҖңеҢ»з–—еҷЁжў°з”ҹдә§вҖқз« иҠӮпјӣдёүжҳҜеҲҶи®ҫвҖңеҢ»з–—еҷЁжў°з»ҸиҗҘдёҺдҪҝз”ЁвҖқз« иҠӮпјӣеўһи®ҫвҖңдёҚиүҜдәӢ件зҡ„еӨ„зҗҶдёҺеҢ»з–—еҷЁжў°зҡ„еҸ¬еӣһвҖқз« иҠӮгҖӮ
дёҺгҖҠжқЎдҫӢгҖӢзӣёе…ій…ҚеҘ—жҖ§и§„з« е’Ң规иҢғжҖ§ж–Ү件жңүеҮ еҚҒйғЁпјҢеҜ№еҠ ејәеҢ»з–—еҷЁжў°зӣ‘з®ЎпјҢдҝғиҝӣеҢ»з–—еҷЁжў°дә§дёҡеҒҘеә·еҝ«йҖҹеҸ‘еұ•пјҢдҝқйҡңдәәж°‘зҫӨдј—з”Ёжў°е®үе…ЁпјҢиө·еҲ°дәҶжһҒеӨ§зҡ„жҺЁеҠЁ
дҪңз”ЁгҖӮзҺ°иЎҢдё»иҰҒжңүпјҡгҖҠеҢ»з–—еҷЁжў°дёҙеәҠиҜ•йӘҢ规е®ҡгҖӢгҖҒгҖҠеҢ»з–—еҷЁжў°ж ҮеҮҶз®ЎзҗҶеҠһжі•гҖӢгҖҒгҖҠеҢ»з–—еҷЁжў°еҲҶзұ»и§„еҲҷгҖӢгҖҒгҖҠеҢ»з–—еҷЁжў°жіЁеҶҢз®ЎзҗҶеҠһжі•гҖӢгҖҒгҖҠеҢ»з–—еҷЁжў°ж–°дә§е“Ғе®Ўжү№и§„е®ҡгҖӢгҖҒгҖҠеҢ»з–—еҷЁжў°з”ҹдә§зӣ‘зқЈз®Ўп§ӨеҠһжі•гҖӢгҖҒгҖҠеҢ»з–—еҷЁжў°з»ҸиҗҘдјҒдёҡи®ёеҸҜиҜҒз®ЎзҗҶеҠһжі•гҖӢгҖҒгҖҠеҢ»з–—еҷЁжў°иҜҙжҳҺд№ҰгҖҒж Үзӯҫе’ҢеҢ…иЈ…ж ҮиҜҶз®ЎзҗҶ规е®ҡгҖӢгҖҒгҖҠеҢ»з–—еҷЁжў°з”ҹдә§дјҒдёҡиҙЁйҮҸз®ЎзҗҶ规иҢғгҖӢгҖҒгҖҠдёҖж¬ЎжҖ§дҪҝз”Ёж— иҸҢеҢ»з–—еҷЁжў°зӣ‘зқЈз®ЎзҗҶеҠһжі•гҖӢгҖҒгҖҠеҢ»з–—еҷЁжў°еҸ¬еӣһз®ЎзҗҶеҠһжі•гҖӢпјҢгҖҠеҢ»з–—еҷЁжў°е№ҝе‘Ҡе®ЎжҹҘеҠһжі•гҖӢгҖҒгҖҠиҚҜе“Ғзӣ‘зқЈиЎҢж”ҝеӨ„зҪҡзЁӢеәҸ规е®ҡгҖӢзӯүгҖӮ
ж–°гҖҠжқЎдҫӢгҖӢе®һиЎҢеҗҺпјҢдёҠиҝ°и§„з« е’Ң规иҢғж–Ү件еӨ§йғЁеҲҶйғҪйңҖиҰҒдҝ®и®ўпјҢеҗҢж—¶е°ҶеўһеҠ ж–°зҡ„规иҢғжҖ§ж–Ү件пјҢеҰӮеҢ»з–—еҷЁжў°з»ҸиҗҘдјҒдёҡгҖҒдҪҝз”ЁеҚ•дҪҚиҙЁйҮҸ规иҢғгҖҒеңЁз”ЁеҢ»з–—еҷЁжў°иҙЁйҮҸз®ЎзҗҶ规иҢғгҖҒеҢ»з–—еҷЁжў°жөҒйҖҡз®ЎзҗҶеҠһжі•зӯүгҖӮ
пјҲеӣӣпјүеёӮеңәзӣ‘з®Ў
еҢ»з–—еҷЁжў°зӣ‘з®ЎиҝҮзЁӢдё»иҰҒеҲҶдёәпјҡдәӢеүҚпјҲеҸ—зҗҶгҖҒе®ЎжҹҘпјүгҖҒдәӢдёӯпјҲе®Ўжү№еүҚзҺ°еңәжЈҖжҹҘжЈҖйӘҢпјүгҖҒдәӢеҗҺзӣ‘з®ЎпјҲдә§е“ҒдёҠеёӮеҗҺеёӮеңәзӣ‘з®ЎпјүгҖӮ
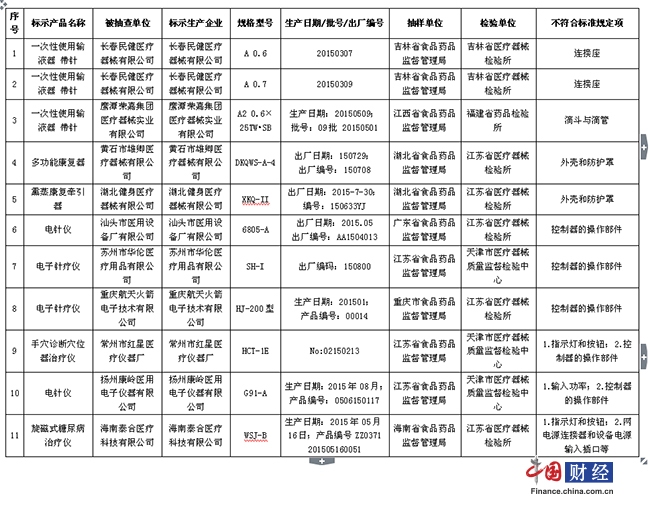
дәӢеҗҺзӣ‘з®Ўдё»иҰҒеҢ…жӢ¬ж—Ҙеёёзӣ‘зқЈжЈҖжҹҘпјҢзӣ‘зқЈжҠҪйӘҢгҖҒдёҚиүҜдәӢ件зӣ‘жөӢгҖҒеҶҚиҜ„д»·гҖҒдә§е“ҒеҸ¬еӣһзӯүеёӮеңәзӣ‘з®ЎпјҢиҝҷжҳҜеёӮеҺҝеұҖеҜ№еҢ»з–—еҷЁжў°зӣ‘з®Ўзҡ„дё»иҰҒд»»еҠЎпјҢе…¶е·ҘдҪңеҠӣеәҰеҰӮдҪ•д№ҹжҳҜжңҖиғҪеҸҚжҳ жң¬йғЁй—Ёзҡ„зӣ‘з®ЎжҲҗж•ҲгҖӮе…¶дё»иҰҒеҜ№зӯ–пјҡйўҶеҜјйҮҚи§ҶпјҢеҠ ејәеҹ№и®ӯпјҢеҲҶжһҗзү№зӮ№пјҢзӘҒеҮәйҮҚзӮ№гҖӮйҖҡеёёеә”еҢ…жӢ¬пјҡе»әз«ӢеҒҘе…Ёиҫ–еҢәеҶ…еҢ»з–—еҷЁжў°з”ҹдә§гҖҒз»ҸиҗҘгҖҒдҪҝз”ЁеҚ•дҪҚзҡ„иҙЁйҮҸжЎЈжЎҲпјҢе°Өе…¶жҳҜж¶үеҸҠй«ҳйЈҺйҷ©зҡ„дә§е“ҒеҚ•дҪҚпјӣе»әз«ӢдјҒдёҡиҜҡдҝЎдҪ“зі»пјӣеҠ ејәж—Ҙеёёзӣ‘зқЈжЈҖжҹҘпјҢеҒҡеҘҪжЈҖжҹҘи®°еҪ•е№¶еҸҠж—¶еҪ’жЎЈпјӣе……еҲҶеҸ‘жҢҘдҝЎжҒҜеҢ–з®ЎзҗҶжҠҖжңҜпјӣзқЈдҝғдјҒдёҡйҒөе®Ҳе№ҙеәҰжҠҘе‘ҠеҲ¶еәҰпјҢеҜ№дәҺеӨұдҝЎдјҒдёҡгҖҒеҮәзҺ°иҝҮиҙЁйҮҸй—®йўҳзҡ„дјҒдёҡеҠ еӨ§жЈҖжҹҘйў‘ж¬ЎзӯүзӯүгҖӮ
зӣ‘зқЈжЈҖжҹҘеҲҶзұ»пјҡдёҖжҳҜиЎҢж”ҝи®ёеҸҜжЈҖжҹҘпјҡз”ійўҶгҖҒеҸҳжӣҙзӯүи®ёеҸҜиҜҒзҺ°еңәжЈҖжҹҘпјӣдәҢжҳҜ常规жЈҖжҹҘпјҡж—Ҙеёёзӣ‘з®ЎпјҢе№ҙеәҰжҷ®жҹҘпјӣдёүжҳҜжңүеӣ жЈҖжҹҘпјҡдё“йЎ№жЈҖжҹҘгҖҒиҙЁйҮҸжҠ•иҜүзҡ„и°ғжҹҘгҖҒдә§е“ҒжҠҪйӘҢдёҚеҗҲж јзҡ„и°ғжҹҘгҖҒйҷҗжңҹж•ҙж”№еҗҺзҡ„еӨҚжҹҘгҖӮ
й«ҳйЈҺйҷ©еҢ»з–—еҷЁжў°дә§е“Ғдё»иҰҒжңүпјҡ 1гҖҒеҝғи„Ҹиө·еҚҡеҷЁпјӣ 2гҖҒдәәе·Ҙеҝғи„Ҹз“ЈиҶңпјӣ 3гҖҒиЎҖз®ЎеҶ…ж”Ҝжһ¶еҸҠеҜјз®Ўпјӣ4гҖҒдёҖж¬ЎжҖ§дҪҝз”ЁеЎ‘ж–ҷиЎҖиўӢпјӣ5гҖҒеҠЁзү©жәҗеҢ»з–—еҷЁжў°е’ҢеҗҢз§ҚеҜјдҪ“еҢ»з–—еҷЁжў°гҖӮ
2014е№ҙ3жңҲ15иҮі8жңҲ30ж—ҘпјҢе…ЁеӣҪејҖеұ•еҢ»з–—еҷЁжў°вҖңдә”ж•ҙжІ»вҖқдё“йЎ№иЎҢеҠЁпјҢе…¶ж•ҙжІ»зӣ®ж ҮпјҢе°ұжҳҜзӘҒеҮәд»ҘзӮ№еёҰйқўгҖҒе…ЁзЁӢзӣ‘з®ЎпјҢе®һиЎҢиҫ№ж•ҙиҫ№е»әгҖҒж•ҙжІ»дёҺ规иҢғ并йҮҚгҖӮжҢүз…§жҺ’жҹҘгҖҒж•ҙжІ»гҖҒ规иҢғзӣёз»“еҗҲзҡ„е·ҘдҪңжЁЎејҸпјҢйҮҮеҸ–жҡ—и®ҝи°ғжҹҘгҖҒйӣҶдёӯжҺ’жҹҘгҖҒзӘҒеҮ»жЈҖжҹҘзӣёз»“еҗҲзҡ„жЈҖжҹҘж–№ејҸпјҢд»ҘйҮҚзӮ№дә§е“ҒгҖҒйҮҚзӮ№дјҒдёҡгҖҒйҮҚзӮ№жЎҲ件зәҝзҙўдёәзӘҒз ҙеҸЈпјҢзқҖеҠӣж•ҙжІ»еҢ»
з–—еҷЁжў°иҷҡеҒҮжіЁеҶҢз”іжҠҘгҖҒиҝқ规з”ҹдә§гҖҒйқһжі•з»ҸиҗҘгҖҒеӨёеӨ§е®Јдј гҖҒдҪҝз”Ёж— иҜҒдә§е“Ғзӯүдә”з§ҚиЎҢдёәгҖӮйҖҡиҝҮдё“йЎ№ж•ҙжІ»пјҢиҗҘйҖ дёҘеҺүжү“еҮ»зҡ„й«ҳеҺӢжҖҒеҠҝпјҢжңүж•Ҳжғ©еӨ„иҝқжі•иҝқ规иЎҢдёәпјҢиҝӣдёҖжӯҘе®Ңе–„зӣ‘з®ЎеҲ¶еәҰжңәеҲ¶пјҢиҫҫеҲ°ж•ҙжІ»дёҖзұ»дә§е“Ғ规иҢғдёҖз§ҚиЎҢдёәзҡ„зӣ®зҡ„пјҢеҲҮе®һдҝқйҡңе…¬дј—з”Ёжў°е®үе…ЁгҖӮзңҒеұҖй«ҳеәҰйҮҚи§ҶпјҢжҲҗз«ӢйўҶеҜје°Ҹз»„пјҢејҖеұ•е№ҝжіӣе®Јдј пјҢзҪ‘з«ҷдёҠи®ҫвҖқдә”ж•ҙжІ»вҖқдё“ж ҸпјҢеҠ ејәжЈҖжҹҘзқЈжҹҘгҖҒжҳҺжҹҘе’Ңжҡ—и®ҝпјҢжҸҗеҮәеҢ»з–—еҷЁжў°з”ҹдә§дјҒдёҡвҖңеҚҒдёҚеҮҶвҖқгҖҒз»ҸиҗҘдјҒдёҡвҖңе…«дёҚеҮҶвҖқгҖҒдҪҝз”ЁеҚ•дҪҚвҖңе…ӯдёҚеҮҶвҖқзҡ„规е®ҡпјҢзЎ®дҝқе…¬дј—з”Ёжў°е®үе…ЁгҖӮ
дёүгҖҒеҢ»з–—еҷЁжў°еӯҳеңЁй—®йўҳ
(дёҖ)еҢ»з–—еҷЁжў°еҸ‘еұ•зҺ°зҠ¶
е…ЁзҗғеҢ»з–—еҷЁжў°дә§еҖје·Іи¶…4000дәҝзҫҺе…ғпјҢеҚ еҢ»иҚҜеёӮеңә42%пјҢеҸ‘иҫҫеӣҪ家иҚҜе“ҒдёҺеҢ»з–—еҷЁжў°дә§еҖјжҜ”иҫҫ1:1пјҢиҝ‘е№ҙжқҘе·ІжҲҗдёәеҸ‘иҫҫеӣҪ家жҸҗеҚҮз”ҹзү©еҢ»иҚҜдә§дёҡе’Ңй«ҳз«ҜиЈ…еӨҮеҲ¶йҖ дёҡзҡ„йҮҚиҰҒжҠ“жүӢпјҢеҸ—еҲ°й«ҳеәҰйҮҚи§ҶпјҢеӣҪйҷ…жҺ’еҗҚеүҚ30дҪҚзҡ„еҢ»з–—еҷЁжў°дјҒдёҡеҚ е…Ёзҗғй”Җе”®жҖ»йўқ80%гҖӮе…Ёзҗғз ”еҸ‘иҙ№з”Ёж”ҜеҮәжҺ’еҗҚеүҚеҚҒеҢ»з–—еҷЁжў°е…¬еҸёпјҢеҰӮ2011е№ҙпјҢејәз”ҹе…¬еҸё75дәҝпјҲеҢ…жӢ¬иҚҜе“ҒпјүпјҢ2010е№ҙеҢ»з–—еҷЁжў°дә§еҖј246дәҝзҫҺе…ғпјӣйӣ…еҹ№е…¬еҸё7.28дәҝз”ЁдәҺеҢ»з–—дә§е“Ғз ”еҸ‘зӯүгҖӮ
жҲ‘еӣҪ2013е№ҙеҢ»з–—еҷЁжў°дә§еҖјпјҢе·ҘдҝЎйғЁз»ҹ计规模д»ҘдёҠдјҒдёҡпјҡеҢ»з–—д»ӘеҷЁи®ҫеӨҮеҸҠеҷЁжў°еҲ¶йҖ 1888.6дәҝгҖҒеҚ«з”ҹжқҗж–ҷеҸҠеҢ»иҚҜз”Ёе“ҒеҲ¶йҖ 1398.2дәҝпјҢеҲҶеҲ«еҗҢжҜ”еўһй•ҝ17.2%гҖҒ21.8%гҖӮеӣҪ家еҢ»з–—еҷЁжў°иЎҢдёҡеҚҸдјҡжҺЁз®—е…ЁиЎҢдёҡдә§еҖји¶…иҝҮ4000дәҝе…ғгҖӮеңЁз ”еҸ‘ж–№йқўпјҢвҖңеҚҒдәҢдә”вҖқжңҹй—ҙпјҢжҠ•еҗ‘з”ҹзү©дә§дёҡзҡ„йҮҚеӨ§ж–°иҚҜз ”еҸ‘еҲӣж–°йўҶеҹҹдё“йЎ№иө„йҮ‘400дәҝпјҢжҜ”вҖңеҚҒдёҖдә”вҖқжңҹй—ҙзҝ»дёҖз•ӘеӨҡгҖӮ
2013е№ҙпјҢе…ЁеӣҪзӣ®еүҚеҢ»з–—еҷЁжў°з”ҹдә§дјҒдёҡ15961家пјҢе…¶дёӯдёҖзұ»4587家пјҢдәҢзұ»8649家пјҢдёүзұ»2725家гҖӮе№ҙдә§еҖј2000дёҮе…ғзҡ„规模д»ҘдёҠдјҒдёҡ900-1000家пјҢеҚ е…Ёзҗғ6%пјӣзәҰеҚ жҲ‘еӣҪиҚҜе“Ғдә§еҖјеӣӣеҲҶд№ӢдёҖгҖӮ2013е№ҙжҲ‘еӣҪеҢ»з–—еҷЁжў°иҙёжҳ“жҖ»йўқиҫҫ343.1дәҝзҫҺе…ғпјҢеҗҢжҜ”еўһй•ҝ14.13% гҖӮиҝӣеҸЈйўқдёә149.75дәҝзҫҺе…ғпјҢеҗҢжҜ”еўһй•ҝ20.07% пјӣе…ұжңү12123家иҝӣеҸЈдјҒдёҡпјҢе…¶дёӯеҶ…иө„дјҒдёҡиҝӣеҸЈйўқдёә89.2дәҝзҫҺе…ғпјҢеҚ 59.66%гҖӮеҮәеҸЈйўқдёә193.35дәҝзҫҺе…ғпјҢеҗҢжҜ”еўһй•ҝ9.92%пјӣе…ұжңү19786家еҮәеҸЈдјҒдёҡпјҢе…¶дёӯеҶ…иө„дјҒдёҡеҮәеҸЈйўқдёә97.12дәҝзҫҺе…ғпјҢеҚ 50.4%гҖӮдё»иҰҒй«ҳз‘һдә§е“ҒиҝҳжҳҜеҗҲиө„дјҒдёҡжҲ–еӨ–иө„дјҒдёҡгҖӮ
жҲ‘зңҒзӣ®еүҚеҢ»з–—еҷЁжў°з”ҹдә§дјҒдёҡ372家пјҢе…¶дёӯ第дёҖзұ»з”ҹдә§дјҒдёҡ98家пјҢ第дәҢзұ»з”ҹдә§дјҒдёҡ229家пјҢ第дёүзұ»з”ҹдә§дјҒдёҡ45家гҖӮж ёеҸ‘зҡ„ж•ҲжңҹеҶ…第дәҢзұ»еҢ»з–—еҷЁжў°жіЁеҶҢиҜҒ556
зҜҮдёү:дёүжҳҜзӘҒеҮәйҮҚзӮ№,иҰҶзӣ–е…ЁйқўгҖӮз»“еҗҲе…·дҪ“еҢ»з–—еҷЁжў°жҠҪжЈҖе“Ғз§Қе’ҢжҲ‘иҫ–еҢәе®һйҷ…жғ…еҶө,гҖӮ
2016е№ҙйЈҹе“ҒиҚҜе“Ғзӣ‘з®Ўж–№жЎҲ(е…ұ5зҜҮ)
第1зҜҮ
дёҖгҖҒжҖ»дҪ“зӣ®ж Ү
е……еҲҶеҸ‘жҢҘе®Јдј е·ҘдҪңзҡ„еҸӮи°ӢеҠ©жүӢе’ҢиҲҶи®әеј•еҜјдҪңз”ЁпјҢжӢ“е®Ҫе®Јдј жё йҒ“пјҢдё°еҜҢе®Јдј иҪҪдҪ“пјҢжү©еӨ§е®Јдј еЈ°еҠҝпјҢжҠўеҚ е®Јдј йҳөең°пјҢжһ„зӯ‘е…Ёж–№дҪҚгҖҒеӨҡи§’еәҰгҖҒз«ӢдҪ“еҢ–зҡ„вҖңеӨ§е®Јдј вҖқж јеұҖпјҢз§ҜжһҒжңҚеҠЎе№¶дҝғиҝӣжҲ‘еҺҝйЈҹе“ҒиҚҜе“Ғзӣ‘з®Ўеҗ„йЎ№е·ҘдҪңгҖӮ
дәҢгҖҒе·ҘдҪңжңәеҲ¶
пјҲдёҖпјүеҠ ејәз»„з»ҮйўҶеҜјгҖӮжҲҗз«Ӣз”ұеұҖй•ҝд»»з»„й•ҝзҡ„е®Јдј е·ҘдҪңйўҶеҜје°Ҹз»„пјҢе°Ҷе®Јдј е·ҘдҪңжҸҗеҲ°йҮҚиҰҒи®®дәӢж—ҘзЁӢгҖӮ
пјҲдәҢпјүдёҘж јдҝқеҜҶе®ЎжҹҘгҖӮз”ұеұҖеҠһе…¬е®ӨиҙҹиҙЈдҝЎжҒҜйҮҮйӣҶгҖҒзј–еҶҷгҖҒе®Ўж ёжҠҠе…іеҸҠеҸ‘еёғзӯүе·ҘдҪңпјҢдёҘж јжү§иЎҢдҝЎжҒҜдҝқеҜҶе®ЎжҹҘ规е®ҡгҖӮ
пјҲдёүпјүжҳҺзЎ®е®Јдј д»»еҠЎгҖӮеҗ„иӮЎе®ӨгҖҒйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈжүҖиҙҹиҙЈеҗ‘еҠһе…¬е®ӨжҠҘйҖҒдҝЎжҒҜгҖӮеҗ„иӮЎе®ӨжҜҸжңҲдёҚдҪҺдәҺ2жқЎпјҢйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈжүҖжҜҸжңҲдёҚдҪҺдәҺ4жқЎгҖӮ
пјҲеӣӣпјүе®Ңе–„еҘ–жғ©еҲ¶еәҰгҖӮеҗ„иӮЎе®ӨгҖҒйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈжүҖжҸҗдҫӣдҝЎжҒҜжғ…еҶөе°ҶдҪңдёәе№ҙеәҰиҖғж ёзҡ„йҮҚиҰҒжҢҮж ҮгҖӮеҸҠж—¶дҝ®и®ўе®Ңе–„дҝЎжҒҜеҘ–еҠұеҲ¶еәҰгҖӮ
дёүгҖҒе®Јдј ж–№ејҸ
пјҲдёҖпјүе…ҡж”ҝдҝЎжҒҜе®Јдј гҖӮеұҖеҠһе…¬е®ӨеңЁеҗ„иӮЎе®ӨпјҲжүҖпјүдёҠжҠҘдҝЎжҒҜзҡ„еҹәзЎҖдёҠз§ҜжһҒеҗ‘е…ҡ委гҖҒж”ҝеәңжҠҘйҖҒж”ҝеҠЎдҝЎжҒҜгҖҒе·ҘдҪңи°ғз ”пјҢе°Ҷе…¶дҪңдёәеҗ‘еҗ„зә§йўҶеҜје®Јдј иҒҢиғҪгҖҒжҠҘе‘Ҡжғ…еҶөгҖҒеҸҚжҳ й—®йўҳгҖҒдәүеҸ–ж”ҜжҢҒгҖҒжҸҗдҫӣеҶізӯ–еҸӮиҖғзҡ„дёҖжқЎйҮҚиҰҒжё йҒ“гҖӮ
пјҲдәҢпјүж–°й—»е®Јдј гҖӮе·©еӣәдёҺж–°й—»еҚ•дҪҚе·Іе»әз«Ӣзҡ„иүҜеҘҪеҚҸдҪңе…ізі»пјӣеҜ№йҮҚеӨ§зҡ„гҖҒзҫӨдј—е…іжіЁзҡ„е·ҘдҪңпјҢйӮҖиҜ·еӘ’дҪ“е…ЁзЁӢеҸӮдёҺйҮҮи®ҝпјӣеҜ№е…·жңүжҺЁе№ҝж„Ҹд№үзҡ„е·ҘдҪңз»ҸйӘҢгҖҒе…Ҳиҝӣе…ёеһӢпјҢиҝӣиЎҢж·ұеәҰжҠҘйҒ“гҖӮ
пјҲдёүпјүзӨҫдјҡе®Јдј гҖӮйҮҮеҸ–зҫӨдј—е–ңй—»д№җи§Ғзҡ„е®Јдј ж–№ејҸпјҢе№ҝжіӣе®Јдј жҷ®еҸҠйҘ®йЈҹз”ЁиҚҜзҹҘиҜҶгҖӮ
еӣӣгҖҒе®Јдј йҮҚзӮ№
пјҲдёҖпјүйӨҗйҘ®е®үе…Ёзӣ‘з®Ў
еңЁйӨҗйҘ®е®үе…Ёзӣ‘з®Ўж–№йқўеҮәеҸ°зҡ„йҮҚиҰҒдёҫжҺӘгҖҒеҲ¶еәҰпјӣйӨҗйҘ®е®үе…Ёдё“йЎ№ж•ҙгҖҒзӣ‘зқЈжҠҪжЈҖзҡ„жҲҗж•ҲпјӣйӨҗйҘ®е®үе…ЁйҡҗжӮЈпјӣйӨҗйҘ®е®үе…ЁжҸҗзӨәгҖҒиӯҰзӨәзӯүгҖӮ
пјҲдәҢпјүиҚҜжў°ж—Ҙеёёзӣ‘з®Ў
еҹәжң¬иҚҜзү©иҙЁйҮҸзӣ‘з®ЎпјӣиҚҜе“Ғе®үе…Ёдё“йЎ№ж•ҙжІ»пјӣGMpгҖҒGSpи·ҹиёӘжЈҖжҹҘпјӣеҶңжқ‘иҚҜе“ҒвҖңдёӨзҪ‘вҖңе»әи®ҫпјӣиҚҜжў°е®үе…ЁдҝЎз”ЁеҲҶзұ»з®ЎзҗҶпјӣиҙЁйҮҸеҸ—жқғдәәгҖҒй©»еә—иҚҜеёҲдҝЎз”Ёз®ЎзҗҶпјӣиҚҜе“Ғд»Һдёҡдәәе‘ҳеҹ№и®ӯзӯүгҖӮ
пјҲдёүпјүдҝқеҢ–е®үе…Ёзӣ‘з®Ў
еңЁдҝқеҢ–е®үе…Ёзӣ‘з®Ўж–№йқўеҮәеҸ°зҡ„йҮҚиҰҒдёҫжҺӘгҖҒеҲ¶еәҰпјӣдҝқеҒҘйЈҹе“Ғдё“йЎ№ж•ҙжІ»жҲҗж•Ҳпјӣе®үе…ЁжҸҗзӨәгҖҒиӯҰзӨәзӯүгҖӮ
пјҲеӣӣпјүзЁҪжҹҘжү“еҒҮ
жү“еҒҮжІ»еҠЈзҡ„йҮҚиҰҒжҲҗжһңпјӣдҫқжі•иЎҢж”ҝзҡ„е…·дҪ“еҒҡжі•пјӣе…ёеһӢжЎҲдҫӢпјӣжҸҗеҚҮзЁҪжҹҘж•ҲиғҪзҡ„еҒҡжі•дёҺжҲҗж•Ҳпјӣеұ•зӨәдёҖзәҝжү§жі•дәәе‘ҳзҡ„йЈҺйҮҮдёҺиү°иҫӣзӯүгҖӮ
пјҲдә”пјүжҠҖжңҜжЈҖжөӢ
е®Јдј йҮҚзӮ№пјҡзӣ‘зқЈжҠҪж ·дёҺиҜ„д»·жҖ§жҠҪж ·жҲҗжһңпјӣжӢ“еұ•жЎҲжәҗзҡ„ж–№ејҸеҲӣж–°пјӣдҝЎжҒҜзЁҪжҹҘпјӣиҚҜе“ҒдёҚиүҜеҸҚеә”зӣ‘жөӢпјӣз”өеӯҗзӣ‘з®Ўпјӣе№ҝе‘Ҡзӣ‘жөӢзӯүгҖӮ
пјҲе…ӯпјүжңҚеҠЎиҚҜжў°з»ҸжөҺ
е®Јдј йҮҚзӮ№пјҡжӢӣе•Ҷеј•иө„жҲҗжһңпјӣеҸ‘жҢҘдјҳеҠҝжңҚеҠЎиҚҜжў°з»ҸжөҺеҸ‘еұ•жғ…еҶөпјӣйҮҚзӮ№иҚҜжў°дјҒдёҡеҸ‘еұ•жғ…еҶөзӯүгҖӮ
пјҲдёғпјүйҳҹдјҚе»әи®ҫ
жңәе…іж•ҲиғҪе»әи®ҫгҖҒдҪңйЈҺе»әи®ҫгҖҒе№ІйғЁж•ҷиӮІеҹ№и®ӯгҖҒзІҫзҘһж–ҮжҳҺе»әи®ҫгҖҒиЎҢж”ҝжү§жі•зӣ‘з®ЎгҖҒзӘ—еҸЈжңҚеҠЎзӯүж–№йқўзҡ„еҲӣж–°дёҺжүҝиҜәгҖӮдёҺйЈҹе“ҒиҚҜе“Ғе®үе…Ёзӣ‘з®Ўе·ҘдҪңз»“еҗҲпјҢеӨ§еҠӣе®Јдј йЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎйҳҹдјҚзҡ„иүҜеҘҪеҪўиұЎгҖӮ
дә”гҖҒе®Јдј зӯ–еҲ’
1.еҠ еӨ§еҜ№е…ёеһӢеӨ„зҪҡжЎҲ件еҸҠеҒҮеҠЈиҚҜжў°гҖҒдҝқеҒҘйЈҹе“ҒгҖҒйӨҗйҘ®йЈҹе“Ғзҡ„жӣқе…үеҠӣеәҰпјҢеҜ“ж”ҝзӯ–法规дәҺжЎҲдҫӢд№ӢдёӯпјҢеҜ“规иҢғзәҰжқҹдәҺжё©йҰЁжҸҗзӨәд№ӢдёӯпјҢд»ҘжЎҲдҫӢзҡ„еҪўејҸеұ•зӨәиҚҜе“Ғжү“еҒҮзҡ„ж–°жҲҗжһңе’ҢйӨҗйҘ®е®үе…Ёзӣ‘з®Ўзҡ„еҠӣеәҰгҖӮ
2.еҠ еӨ§еҜ№иҚҜжў°з»ҸжөҺзҡ„е®Јдј еҠӣеәҰе’ҢеҜҶеәҰпјҢз»„з»ҮеҜ№йҮҚзӮ№дјҒдёҡиҝӣиЎҢжҠҘйҒ“гҖӮ
3.继з»ӯжҺЁеҮәйҘ®йЈҹз”ЁиҚҜе®үе…ЁжҸҗзӨәгҖӮ
4.继з»ӯејҖеұ•вҖңйЈҹе“ҒиҚҜе“Ғе®үе…ЁзҹҘиҜҶ科жҷ®вҖқжҙ»еҠЁпјҢд»ҘзӨҫеҢәгҖҒд№Ўй•ҮгҖҒеӯҰж ЎдёәйҮҚзӮ№пјҢдёҫеҠһвҖңйЈҹе“ҒиҚҜе“Ғе®үе…ЁзҹҘиҜҶеӨ§и®Іе ӮвҖқгҖӮ
5.зј–еҸ‘гҖҠйЈҹе“ҒиҚҜе“Ғзӣ‘з®Ўз®ҖжҠҘгҖӢпјҢжҜҸжңҲдёҚе°‘дәҺ1жңҹпјҢеҗ‘еӣӣеӨ§е®¶йўҶеҜјеҸҠеҺҝзӣҙеҗ„еҚ•дҪҚжҷ®еҸ‘гҖӮ
第2зҜҮдёҖгҖҒз»„з»ҮејҖеұ•е…ҡзҡ„еҚҒе…«еӨ§зІҫзҘһеӯҰд№ иҙҜеҪ»жҙ»еҠЁе’ҢиҝӣдёҖжӯҘеҠ ејәе…ҡйЈҺе»үж”ҝе»әи®ҫгҖӮе°ҶеӯҰд№ иҙҜеҪ»е…ҡзҡ„еҚҒе…«еӨ§зІҫзҘһдҪңдёәйҰ–иҰҒж”ҝжІ»д»»еҠЎжҠ“зҙ§жҠ“еҘҪгҖӮеқҡжҢҒе·ҘеӯҰдёҖдҪ“еҢ–пјҢйҖҡиҝҮдё“йўҳе®Јдј гҖҒеӯҰд№ еҹ№и®ӯгҖҒеә§и°Ҳз ”и®ЁзӯүеҪўејҸпјҢж·ұе…ҘејҖеұ•е…ҡзҡ„еҚҒе…«еӨ§зІҫзҘһеӯҰд№ е®Јдј иҙҜеҪ»жҙ»еҠЁгҖӮеҠ ејәжңәе…іе…ҡе»әе·ҘдҪңпјҢејәеҢ–е…ҡе»әиҖғж ёпјҢиҝӣдёҖжӯҘиҗҪе®һе…ҡе»әе·ҘдҪңиҙЈд»»еҲ¶пјҢдёҚж–ӯжҸҗеҚҮе…ҡе»әж°ҙе№ігҖӮеҠ ејәжғ©жІ»е’Ңйў„йҳІи…җиҙҘдҪ“зі»е»әи®ҫпјҢзӯ‘зүўжҖқжғійҒ“еҫ·йҳІзәҝгҖӮ继з»ӯжҺЁиҝӣе»үж”ҝйЈҺйҷ©йҳІжҺ§е·ҘдҪңпјҢеҠ ејәеҜ№е…ій”®еІ—дҪҚе’ҢйҮҚзӮ№зҺҜиҠӮзҡ„зӣ‘зқЈгҖӮ继з»ӯејҖеұ•вҖңе»үж”ҝж–ҮеҢ–е»әи®ҫзӨәиҢғзӮ№вҖқз”іжҠҘе·ҘдҪңпјҢиҗҘйҖ йЈҺжё…ж°”жӯЈзҡ„иүҜеҘҪж°ӣеӣҙгҖӮеҲҮе®һж”№иҝӣе·ҘдҪңдҪңйЈҺпјҢдёҘж јиҙҜеҪ»иҗҪе®һдёҠзә§иҰҒжұӮпјҢеҠӘеҠӣдҪҝеҺүиЎҢеӢӨдҝӯиҠӮзәҰгҖҒеҸҚеҜ№й“әеј жөӘиҙ№еңЁе…ЁеұҖи”ҡ然жҲҗйЈҺгҖӮ
дәҢгҖҒж·ұе…ҘејҖеұ•йЈҹе“ҒиҚҜе“Ғе®үе…ЁзӨәиҢғеҺҝеҲӣе»әе·ҘдҪңгҖӮеӣҙз»•вҖңеӨҜеҹәзЎҖгҖҒејәзӣ‘з®ЎгҖҒе»әжңәеҲ¶гҖҒеҲӣзү№иүІгҖҒйҖ ж°ӣеӣҙвҖқзҡ„еҲӣе»әе·ҘдҪңжҖқи·ҜпјҢжҢүз…§2016е№ҙе…ЁзңҒйЈҹе“ҒиҚҜе“Ғе®үе…ЁзӨәиҢғеҺҝеҲӣе»әе·ҘдҪңзҺ°еңәжҺЁиҝӣдјҡзҡ„иҰҒжұӮпјҢзқҖеҠӣжҠ“еҘҪеҶңжқ‘йЈҹе“ҒиҚҜе“Ғе®үе…Ёзҡ„иҙЈд»»дҪ“зі»гҖҒиҜҡдҝЎдҪ“зі»гҖҒйЈҺйҷ©йҳІжҺ§дҪ“зі»е’ҢзӨҫдјҡзӣ‘з®ЎдҪ“зі»зӯүвҖңеӣӣеӨ§дҪ“зі»вҖқе»әи®ҫпјҢе·©еӣәе’ҢжҸҗеҚҮзӨәиҢғеҺҝеҲӣе»әжҲҗжһңгҖӮ
дёүгҖҒ继з»ӯжҺЁиҝӣйЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎдҪ“зі»е»әи®ҫгҖӮдёҚж–ӯе®Ңе–„зӣёе…ізӣ‘з®ЎеҲ¶еәҰпјҢеҠ еӨ§жү§жі•зӣ‘зқЈеҠӣеәҰпјҢд»ҘиЎҢж”ҝеӨ„зҪҡиЈҒйҮҸжқғ规иҢғжғ…еҶөеҸҠиЎҢеҲ‘й“ҫжҺҘжғ…еҶөдёәйҮҚзӮ№пјҢз»„з»Үдё“йЎ№жү§жі•зӣ‘зқЈжЈҖжҹҘе’Ңжү§жі•жЎҲ件иҜ„жҹҘпјҢе»әз«ӢиЎҢж”ҝеӨ„зҪҡиЈҒйҮҸе…ёеһӢжЎҲдҫӢеҲ¶еәҰгҖӮеҠ еҝ«жү§жі•иЈ…еӨҮгҖҒдҝЎжҒҜеҢ–гҖҒжҠҖжңҜж”Ҝж’‘зӯүйҮҚзӮ№йЎ№зӣ®е»әи®ҫгҖӮжҠ“еҘҪйЈҹе“ҒиҚҜе“ҒжЈҖйӘҢжңәжһ„гҖҒдёҚиүҜеҸҚеә”зӣ‘жөӢжңәжһ„е»әи®ҫпјҢйҖҗжӯҘжҸҗеҚҮжЈҖйӘҢзӣ‘жөӢе·ҘдҪңж°ҙе№ігҖӮеҠ ејәжү§дёҡд»Һдёҡдәәе‘ҳе’ҢиҙЁйҮҸз®ЎзҗҶдәәе‘ҳзҡ„еҹ№и®ӯе’Ңж•ҷиӮІе·ҘдҪңгҖӮе…ЁйқўиҙҜеҪ»гҖҠе…ЁеӣҪйЈҹе“ҒиҚҜе“Ғзӣ‘з®Ўдёӯй•ҝжңҹдәәжүҚеҸ‘еұ•и§„еҲ’гҖӢпјҢ继з»ӯжҺЁиҝӣдәәжүҚе…ҙдёҡе·ҘзЁӢпјҢеҠ ејәйЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎдёҡеҠЎеҹ№и®ӯе·ҘдҪңгҖӮеӨҜе®һеҹәеұӮзӣ‘з®ЎеҹәзЎҖпјҢжҺЁеҠЁеҶңжқ‘йЈҹе“ҒиҚҜе“Ғзӣ‘з®Ўз«ҷе»әи®ҫпјҢе®Ңе–„вҖңеӣӣе‘ҳвҖқпјҲйЈҹе“ҒиҚҜе“Ғе®үе…Ёз®ЎзҗҶе‘ҳгҖҒйЈҹе“ҒиҚҜе“Ғе®үе…Ёе®Јдј е‘ҳгҖҒйЈҹе“ҒиҚҜе“Ғе®үе…ЁеҚҸз®Ўе‘ҳгҖҒйЈҹе“ҒиҚҜе“Ғе®үе…ЁдҝЎжҒҜе‘ҳпјүзӣ‘з®Ўе·ҘдҪңжңәеҲ¶пјҢйҖҗжӯҘеҪўжҲҗеҺҝгҖҒд№ЎпјҲй•ҮпјүгҖҒжқ‘дёүзә§йЈҹе“ҒиҚҜе“Ғе®үе…Ёзӣ‘з®ЎзҪ‘з»ңгҖӮ
еӣӣгҖҒеҠ ејәиҚҜе“Ғе’ҢеҢ»з–—еҷЁжў°зӣ‘з®ЎгҖӮдё»еҠЁжңҚеҠЎеҢ»ж”№еӨ§еұҖпјҢй’ҲеҜ№еҹәжң¬иҚҜзү©е’ҢеҺҝзә§е…¬з«ӢеҢ»йҷўеҹәжң¬з”ЁиҚҜе“Ғз§ҚпјҢејәеҢ–з”ҹдә§гҖҒй…ҚйҖҒгҖҒдҪҝз”ЁзҺҜиҠӮзӣ‘з®ЎпјҢеҜ№еҹәжң¬иҚҜзү©е’Ңй«ҳйЈҺйҷ©е“Ғз§Қе®һж–Ҫе…ЁиҰҶзӣ–жҠҪйӘҢгҖӮеҠ ејәиҚҜе“ҒдёҚиүҜеҸҚеә”зӣ‘жөӢе·ҘдҪңгҖӮ继з»ӯжҺЁиҝӣеҹәжң¬иҚҜзү©гҖҒйӣ¶е”®иҚҜе“Ғз”өеӯҗзӣ‘з®ЎпјҢй’ҲеҜ№еӣҪ家еҹәжң¬иҚҜзү©е“Ғз§Қзӣ®еҪ•зҡ„и°ғж•ҙпјҢеҒҡеҘҪж–°еўһеҹәжң¬иҚҜзү©е“Ғз§Қзҡ„з”өеӯҗзӣ‘з®Ўе·ҘдҪңгҖӮз»„з»Үе®һж–Ҫж–°дҝ®и®ўгҖҠиҚҜе“Ғз»ҸиҗҘиҙЁйҮҸз®ЎзҗҶ规иҢғгҖӢпјҢеҸ‘жҢҘйӘЁе№ІдјҒдёҡзҺҮе…ҲиҫҫеҲ°ж–°дҝ®и®ўGSpзҡ„зӨәиҢғеј•йўҶдҪңз”ЁгҖӮеҠ ејәе№ҝе‘Ҡе’Ңдә’иҒ”зҪ‘зӣ‘з®ЎпјҢе®Ңе–„е№ҝе‘Ҡзӣ‘жөӢзҪ‘з»ңпјҢеҠ ејәдә’иҒ”зҪ‘еҸ‘еёғиҚҜе“ҒдҝЎжҒҜе’ҢдәӨжҳ“иЎҢдёәеҠЁжҖҒзӣ‘жөӢгҖӮдёҘеҺүжү“еҮ»еҸ‘еёғиҷҡеҒҮе№ҝе‘Ҡе’Ңдә’иҒ”зҪ‘иҷҡеҒҮиҚҜе“ҒдҝЎжҒҜиҝқжі•иЎҢдёәгҖӮеҠ ејәй«ҳйЈҺйҷ©еҢ»з–—еҷЁжў°зӣ‘з®ЎпјҢйҮҚзӮ№ејәеҢ–ж— иҸҢе’ҢжӨҚе…Ҙзұ»еҷЁжў°з”ҹдә§зӣ‘зқЈжЈҖжҹҘгҖӮеҠ еҝ«жҺЁиҝӣгҖҠеҢ»з–—еҷЁжў°з”ҹдә§иҙЁйҮҸз®ЎзҗҶ规иҢғгҖӢе®һж–Ҫе·ҘдҪңгҖӮ
дә”гҖҒејәеҢ–йӨҗйҘ®йЈҹе“ҒгҖҒдҝқеҒҘйЈҹе“ҒгҖҒеҢ–еҰҶе“Ғз»ҸиҗҘзӣ‘з®ЎгҖӮејәеҢ–иЎҢж”ҝи®ёеҸҜе·ҘдҪңпјҢжҠҠеҘҪйӨҗйҘ®жңҚеҠЎи®ёеҸҜе…Ҙй—Ёе…ігҖӮеҠ еҝ«жҺЁиҝӣйӨҗйҘ®жңҚеҠЎйЈҹе“Ғзӣ‘зқЈйҮҸеҢ–еҲҶзә§з®ЎзҗҶпјҢеҠӣдәүеңЁ2016е№ҙ6жңҲеә•еүҚеҜ№жҢҒиҜҒйӨҗйҘ®еҚ•дҪҚе®һж–Ҫе…ЁиҰҶзӣ–гҖӮеҲҮе®һеҒҡеҘҪйҮҚеӨ§жҙ»еҠЁйӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…Ёдҝқйҡңе·ҘдҪңгҖӮеҠ ејәйӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…Ёзӣ‘зқЈжҠҪжЈҖе·ҘдҪңгҖӮ继з»ӯе·©еӣәе’ҢејәеҢ–еӯҰж ЎйЈҹе Ӯе’ҢеҶң家д№җзӯүйҮҚзӮ№еҚ•дҪҚйӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…Ёзӣ‘з®ЎгҖӮеҠ ејәеҜ№еҶңжқ‘иҮӘеҠһйӨҗйҘ®е®ҙеёӯзҡ„зӣ‘з®ЎеҠӣеәҰпјҢе…ЁйқўжҺЁиҝӣе°ҸйӨҗйҘ®ж•ҙйЎҝ规иҢғиҜ•зӮ№е·ҘдҪңгҖӮеҠ ејәйӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…ЁдәӢж•…еә”жҖҘеӨ„зҪ®е·ҘдҪңпјҢе®Ңе–„йӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…ЁдәӢж•…еә”жҖҘеӨ„зҪ®йў„жЎҲгҖӮеҠ ејәдҝқеҢ–ж—Ҙеёёзӣ‘з®ЎпјҢ规иҢғиҜҙжҳҺд№Ұж Үзӯҫз®ЎзҗҶпјҢејәеҢ–йҮҚзӮ№дә§е“Ғзӣ‘зқЈжЈҖжҹҘпјҢдёҘеҺүжү“еҮ»йқһжі•ж·»еҠ иҝқжі•иҝқ规иЎҢдёәгҖӮејҖеұ•дҝқеҒҘйЈҹе“ҒеҢ–еҰҶе“ҒзӨәиҢғе·ҘзЁӢе»әи®ҫпјҢејҖеұ•дҝқеҒҘйЈҹе“ҒиҙЁйҮҸе®үе…ЁдёҮйҮҢиЎҢжҙ»еҠЁгҖӮ
е…ӯгҖҒж·ұеҢ–йЈҹе“ҒиҚҜе“Ғе®үе…Ёдё“йЎ№ж•ҙжІ»гҖӮиҝӣдёҖжӯҘе®Ңе–„иҚҜе“ҒгҖҒеҢ»з–—еҷЁжў°гҖҒйӨҗйҘ®жңҚеҠЎйЈҹе“ҒгҖҒдҝқеҒҘйЈҹе“Ғе’ҢеҢ–еҰҶе“ҒеӨ§жЎҲиҰҒжЎҲзқЈеҠһеҲ¶еәҰпјҢеҒҘе…Ёе®Ңе–„йғЁй—Ёжү“еҒҮеҚҸдҪңжңәеҲ¶гҖӮ继з»ӯејҖеұ•и§„иҢғдёӯиҚҜз”ҹдә§з»ҸиҗҘ秩еәҸдё“йЎ№иЎҢеҠЁпјҢдёҘеҺүжү“еҮ»дёӯиҚҜжқҗгҖҒдёӯиҚҜйҘ®зүҮжҹ“иүІгҖҒеўһйҮҚзӯүиҝқжі•иЎҢдёәгҖӮж·ұе…ҘејҖеұ•йӨҗйҘ®жңҚеҠЎзҺҜиҠӮйЈҹе“ҒиҝқзҰҒи¶…йҷҗгҖҒеҒҮеҶ’дјӘеҠЈдё“йЎ№ж•ҙжІ»е’ҢйҮҚзӮ№е“Ғз§Қз»јеҗҲжІ»зҗҶе·ҘдҪңпјҢ继з»ӯжҺЁиҝӣеӯҰж ЎйЈҹе ӮгҖҒе»әзӯ‘е·Ҙең°йЈҹе ӮзӯүйҮҚзӮ№еҚ•дҪҚзҡ„дё“йЎ№ж•ҙжІ»гҖӮ继з»ӯж·ұе…ҘејҖеұ•дҝқеҒҘйЈҹе“Ғиҝқжі•ж·»еҠ еҢ–еӯҰиҚҜзү©жҲҗеҲҶе’ҢеҢ–еҰҶе“Ғиҝқжі•дҪҝз”ЁзҰҒйҷҗзү©иҙЁдё“йЎ№ж•ҙжІ»е·ҘдҪңгҖӮиҗҪе®һеӣҪ家еұҖгҖҒиҙўж”ҝйғЁеҮәеҸ°зҡ„гҖҠйЈҹе“ҒиҚҜе“Ғиҝқжі•иЎҢдёәдёҫжҠҘеҘ–еҠұеҠһжі•гҖӢпјҢеҠ ејәеҗ„зұ»жҠ•иҜүдёҫжҠҘеҸҠдҝЎи®ҝжЎҲ件зҡ„жҹҘеӨ„е’ҢеҠһзҗҶе·ҘдҪңпјҢеҠ ејә12331з”өиҜқжҠ•иҜүдёҫжҠҘзҪ‘з»ңе»әи®ҫгҖӮ
дёғгҖҒе…ЁйқўжҺЁиҝӣдҝЎжҒҜеҢ–е»әи®ҫгҖӮеҠ еҝ«иЎҢж”ҝе®Ўжү№з®ЎзҗҶзі»з»ҹе»әи®ҫпјҢжҺЁиҝӣиҚҜе“Ғз”ҹдә§з»ҸиҗҘдјҒдёҡиҝңзЁӢзӣ‘з®Ўзі»з»ҹеә”з”ЁпјҢе®Ңе–„иҚҜе“ҒжіЁеҶҢдҝЎжҒҜз®ЎзҗҶзі»з»ҹе»әи®ҫгҖӮжҺЁиЎҢиҚҜе“Ғжү№еҸ‘дјҒдёҡеҶ·еә“жё©ж№ҝеәҰе®һж—¶еңЁзәҝзӣ‘жҺ§пјҢжҸҗй«ҳзӣ‘з®Ўж•ҲзҺҮгҖӮжҺЁиҝӣдҝқеҒҘйЈҹе“ҒеҢ–еҰҶе“Ғз»ҸиҗҘдјҒдёҡзӣ‘з®ЎдҝЎжҒҜеҢ–е»әи®ҫпјҢе®һзҺ°е®һж—¶гҖҒеҠЁжҖҒзӣ‘жҺ§гҖӮжҺўзҙўе»әз«ӢйӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…Ёзӣ‘з®ЎдҝЎжҒҜеҢ–е»әи®ҫе№іеҸ°пјҢеҠ еҝ«е»әз«ӢеҠЁжҖҒзӣ‘з®ЎгҖҒдҝЎз”ЁиҜ„д»·гҖҒе®ҲдҝЎжҝҖеҠұгҖҒеӨұдҝЎжғ©жҲ’зҡ„дҝЎжҒҜзі»з»ҹгҖӮ
е…«гҖҒе»әз«Ӣе®Ңе–„йЈҺйҷ©йҳІжҺ§дҪ“зі»гҖӮ继з»ӯејҖеұ•дҝқеҒҘйЈҹе“ҒгҖҒеҢ–еҰҶе“Ғе®үе…ЁйЈҺйҷ©зӣ‘жөӢе·ҘдҪңпјҢжҢүз…§ж—Ҙеёёзӣ‘з®ЎгҖҒдё“йЎ№ж•ҙжІ»гҖҒиҝқжі•жҹҘеӨ„зӯүдёүдҪҚдёҖдҪ“зҡ„жҖқи·ҜпјҢзқҖеҠӣжҺ§еҲ¶е’Ңж¶ҲйҷӨдҝқеҢ–дә§е“Ғзҡ„иҙЁйҮҸе®үе…ЁйҡҗжӮЈгҖӮй”Ғе®ҡйҮҚзӮ№еңәжүҖгҖҒйҮҚзӮ№е“Ғз§ҚгҖҒйҮҚзӮ№ж—¶ж®өпјҢејәеҢ–йӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…ЁйЈҺйҷ©зӣ‘жөӢе’Ңж—Ҙеёёзӣ‘з®ЎпјҢйҳІжҺ§зҫӨдҪ“жҖ§йЈҹзү©дёӯжҜ’дәӢ件еҸ‘з”ҹгҖӮе»әз«Ӣе®Ңе–„иҚҜе“ҒиҙЁйҮҸе®үе…ЁеҲҶжһҗдјҡеҲ¶еәҰпјҢе®ҡжңҹжҺ’жҹҘиҚҜе“ҒиҙЁйҮҸйЈҺйҷ©е’Ңе®үе…ЁйҡҗжӮЈгҖӮ规иҢғиҚҜжў°дёҚиүҜеҸҚеә”вҖңдәӢ件вҖқеә”жҖҘеӨ„зҪ®зЁӢеәҸгҖӮе»әз«ӢеҒҘе…ЁйЈҹе“ҒиҚҜе“Ғе®үе…ЁзӘҒеҸ‘дәӢ件дҝЎжҒҜеҝ«йҖҹжҠҘйҖҒе’ҢйҖҡжҠҘе·ҘдҪңжңәеҲ¶гҖӮ
д№қгҖҒ继з»ӯејҖеұ•вҖңеӨ§е®Јдј вҖқжҙ»еҠЁгҖӮеҠ ејәдёҺж–°й—»еӘ’дҪ“зҡ„еҗҲдҪңпјҢз»„з»ҮеӘ’дҪ“и®°иҖ…ж·ұе…Ҙжү§жі•дёҖзәҝпјҢз§ҜжһҒжҢ–жҺҳе’Ңе®Јдј жҠҘйҒ“е…Ҳиҝӣе…ёеһӢгҖӮз»„з»Үе®һж–Ҫе…ЁеӣҪе®үе…Ёз”ЁиҚҜжңҲгҖҒйЈҹе“ҒиҚҜе“Ғе®ү全科жҷ®е®Јдј иЎҢеҠЁи®ЎеҲ’пјҢе№ҝжіӣе®Јдј е®үе…ЁйҘ®йЈҹз”ЁиҚҜзҹҘиҜҶгҖӮ继з»ӯеҒҡеҘҪвҖңеӣӣе“ҒдёҖжў°вҖқд»Һдёҡдәәе‘ҳзҡ„ж•ҷиӮІеҹ№и®ӯе·ҘдҪңгҖӮз»„з»ҮеёӮж°‘ејҖж”ҫж—Ҙжҙ»еҠЁгҖҒе…¬дј—еҒҮжңҹеҸҠдёӯжӢӣй«ҳиҖғзӯүйҮҚзӮ№ж—¶ж®өйӨҗйҘ®йЈҹе“Ғе’ҢиҚҜе“Ғе®үе…Ёдё“йЎ№ж•ҙжІ»е·ҘдҪңдёӯпјҢйӮҖиҜ·еӘ’дҪ“е’ҢеёӮж°‘д»ЈиЎЁгҖҒзӣ‘зқЈе‘ҳеҸӮдёҺзӣ‘зқЈжЈҖжҹҘгҖӮеҒҘе…Ёж–°й—»еҸ‘еёғдјҡеҲ¶еәҰпјҢеҒҡеҘҪзӘҒеҸ‘дәӢ件зҡ„еә”жҖҘеӨ„зҪ®еҸҠйҮҚеӨ§йЈҹе“ҒиҚҜе“ҒжЎҲ件зҡ„е®Јдј жҠҘйҒ“гҖӮ
еҚҒгҖҒдҝғиҝӣеҢ»иҚҜдә§дёҡз»ҸжөҺеҸҲеҘҪеҸҲеҝ«еҸ‘еұ•гҖӮе……еҲҶеҲ©з”Ёзӣ‘з®ЎйғЁй—Ёж”ҝзӯ–гҖҒдҝЎжҒҜгҖҒжҠҖжңҜдјҳеҠҝпјҢеҠ еӨ§её®жү¶еҠӣеәҰпјҢз§ҜжһҒдёәжҲ‘еҺҝеҢ»иҚҜдјҒдёҡеҸ‘еұ•дәүеҸ–йЎ№зӣ®гҖҒж”ҝзӯ–ж”ҜжҢҒгҖҒиө„йҮ‘жҠ•е…ҘпјҢеҠӘеҠӣжҸҗй«ҳеҢ»иҚҜдә§дёҡж ёеҝғз«һдәүеҠӣпјҢдҝғиҝӣе…ЁеҺҝеҢ»иҚҜдјҒдёҡдёҠ规模дёҠж°ҙе№іпјҢе®һзҺ°дёҺвҖңжҢҜе…ҙзҡ–иҚҜвҖқи®ЎеҲ’еҜ№жҺҘгҖӮ
第3зҜҮдёҖгҖҒжҢҮеҜјжҖқжғі
жҢүз…§зңҒ委ж•ҷиӮІе®һи·өжҙ»еҠЁйўҶеҜје°Ҹз»„зҡ„йғЁзҪІе’ҢиҰҒжұӮпјҢзқҖзңјзә жӯЈжҚҹе®ізҫӨдј—еҲ©зӣҠиЎҢдёәпјҢзҙ§зҙ§еӣҙз»•зӨҫдјҡеҚұе®ідёҘйҮҚгҖҒзҫӨдј—еҸҚжҳ ејәзғҲзҡ„йЈҹе“ҒиҚҜе“Ғе®үе…Ёй—®йўҳпјҢд»Ҙж·ұе…ҘејҖеұ•зҫӨдј—и·Ҝзәҝж•ҷиӮІе®һи·өжҙ»еҠЁдёәеҠЁеҠӣпјҢдёҘж јиҗҪе®һйЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎиҙЈд»»еҲ¶пјҢзқҖеҠӣејҖеұ•йЈҹе“ҒиҚҜе“Ғе®үе…Ёдё“йЎ№ж•ҙжІ»пјҢдёҘеҺүжү“еҮ»еҲ¶е”®вҖңдёүж— вҖқйЈҹе“Ғе’ҢеҒҮеҠЈиҚҜе“Ғзӯүиҝқжі•зҠҜзҪӘиЎҢдёәпјҢеҲҮе®һз»ҙжҠӨзҫӨдј—еҗҲжі•жқғзӣҠгҖӮ
дәҢгҖҒйЈҹе“ҒиҚҜе“Ғе®үе…Ёдё“йЎ№ж•ҙжІ»е·ҘдҪңйҮҚзӮ№
пјҲдёҖпјүејҖеұ•з•ңзҰҪдә§е“ҒиҙЁйҮҸе®үе…Ёдё“йЎ№иЎҢеҠЁ
1гҖҒзӣ®ж ҮпјҡйҖҡиҝҮдё“йЎ№иЎҢеҠЁпјҢиҫҫеҲ°и§„иҢғз•ңзү§е…»ж®–зҺҜиҠӮз”ЁиҚҜпјҢ
жҸҗй«ҳз•ңдә§е“ҒиҙЁйҮҸж°ҙе№ізҡ„зӣ®ж ҮгҖӮе…ҪиҚҜж®Ӣз•ҷжҠҪжЈҖеҗҲж јзҺҮиҫҫ99%д»ҘдёҠпјҢйҘІж–ҷдә§е“ҒжҠҪжЈҖеҗҲж јзҺҮиҫҫ90%д»ҘдёҠпјҢиҝқжі•жЎҲ件жҹҘеӨ„зҺҮиҫҫ100%гҖӮ
2гҖҒе·ҘдҪңжҺӘж–ҪпјҡдёҖжҳҜеҜ№е…ЁзңҒ规模养殖еңәпјҲжҲ·пјүдҪҝз”ЁиҝқзҰҒиҚҜзү©е…ЁйқўжҺ’жҹҘгҖӮеҗ„ең°еҜ№ж ҮеҮҶеҢ–е…»ж®–еңәгҖҒе…»ж®–е°ҸеҢәиҝӣиЎҢз”ЁиҚҜжғ…еҶөеӨ§жЈҖжҹҘпјҢйҮҚзӮ№жЈҖжҹҘе…»ж®–жЎЈжЎҲгҖҒз”ЁиҚҜи®°еҪ•гҖҒдј‘иҚҜжңҹ规е®ҡжү§иЎҢжғ…еҶөгҖӮдәҢжҳҜжҺЁиЎҢе…»ж®–дјҒдёҡиҙЁйҮҸе®үе…ЁжүҝиҜәеҲ¶еәҰпјҢдҝғиҝӣе…»ж®–дёҡиҖ…规иҢғз”ЁиҚҜгҖӮдёүжҳҜејҖеұ•йҘІж–ҷдҪҝз”Ёжғ…еҶөжЈҖжҹҘгҖӮе…»ж®–зҺҜиҠӮеҜ№е®¶зҰҪгҖҒз”ҹзҢӘгҖҒеҘ¶зүӣе…»ж®–еңәпјҲжҲ·пјүиҮӘй…ҚйҘІж–ҷиҝӣиЎҢе…ЁиҰҶзӣ–жЈҖжҹҘпјӣз»ҸиҗҘзҺҜиҠӮпјҢйҮҚзӮ№жЈҖжҹҘй…ҚеҗҲйҘІж–ҷгҖҒиҚҜзү©ж·»еҠ еүӮйў„ж··йҘІж–ҷгҖӮеӣӣжҳҜејҖеұ•дё“йЎ№жЈҖжөӢгҖӮеҜ№е…»ж®–еңәпјҲжҲ·пјүиҝӣиЎҢз”ЁиҚҜжғ…еҶөе’ҢиҝқзҰҒиҚҜзү©жҠҪжЈҖзӣ‘жөӢпјҢ规模д»ҘдёҠе…»ж®–еңәпјҲжҲ·пјүжҠҪйӘҢзӣ‘жөӢзҺҮиҫҫ100%гҖӮ
3гҖҒиҙЈд»»еҚ•дҪҚпјҡзңҒеҶң委гҖҒзңҒйЈҹе®үеҠһгҖӮ
пјҲдәҢпјүејҖеұ•д№іе“ҒиҙЁйҮҸе®үе…Ёдё“йЎ№иЎҢеҠЁ
1гҖҒзӣ®ж ҮпјҡйҖҡиҝҮејәеҢ–зӣ‘з®ЎгҖҒз»јеҗҲж–Ҫзӯ–пјҢе…ЁйқўжҸҗй«ҳжҲ‘зңҒд№іе“ҒиҙЁйҮҸе®үе…Ёж°ҙе№іпјҢз»ҙжҠӨдәәж°‘зҫӨдј—еҲҮиә«еҲ©зӣҠпјҢжҸҗжҢҜж¶Ҳиҙ№дҝЎеҝғгҖӮ
2гҖҒе·ҘдҪңжҺӘж–ҪпјҡдёҖжҳҜејәеҢ–зӣ‘зқЈзӣ‘з®ЎгҖӮеҠ ејәеҜ№д№іе“Ғз”ҹдә§дјҒдёҡзҡ„зӣ‘зқЈжЈҖжҹҘпјҢйҮҚзӮ№ејҖеұ•дјҒдёҡжҢҒз»ӯдҝқжҢҒи®ёеҸҜжқЎд»¶гҖҒз”ҹдә§иҝҮзЁӢи®°еҪ•е’ҢеӨҮжЎҲеҲ¶еәҰжү§иЎҢжғ…еҶөжҹҘйӘҢпјҢз»„з»ҮеҜ№з”ҹдә§дјҒдёҡжЈҖйӘҢиғҪеҠӣиҝӣиЎҢиҖғж ёгҖӮеҸӮз…§иҚҜе“Ғз®ЎзҗҶеҠһжі•пјҢдёҘж је©ҙе№је„ҝй…Қж–№д№ізІүз”ҹдә§и®ёеҸҜпјҢејҖеұ•з”ҹдә§дјҒдёҡеҶҚе®Ўж ёгҖҒеҶҚжё…зҗҶе·ҘдҪңгҖӮиҝӣдёҖжӯҘ规иҢғе©ҙе№је„ҝй…Қж–№д№ізІүж Үзӯҫж ҮиҜҶпјҢеҠ еӨ§еҜ№еҢ…иЈ…гҖҒж Үзӯҫж ҮиҜҶзӯүзҡ„зӣ‘зқЈжЈҖжҹҘеҠӣеәҰпјҢйҳІжӯўйқһжі•дә§е“ҒжөҒе…ҘеёӮеңәгҖӮдәҢжҳҜеҠ еӨ§жү“еҮ»жғ©еӨ„еҠӣеәҰгҖӮдёҘеҺүжү“еҮ»ж— иҜҒз”ҹдә§гҖҒйқһжі•ж·»еҠ йқһйЈҹз”Ёзү©иҙЁгҖҒи¶…иҢғеӣҙи¶…йҷҗйҮҸдҪҝз”ЁйЈҹе“Ғж·»еҠ еүӮе’ҢзҜЎж”№з”ҹдә§ж—ҘжңҹгҖҒж¶Ӯж”№ж Үзӯҫж ҮиҜҶзӯүиҝқжі•иЎҢдёәгҖӮ
3гҖҒиҙЈд»»еҚ•дҪҚпјҡзңҒйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖгҖҒзңҒиҙЁзӣ‘еұҖгҖӮ
пјҲдёүпјүејҖеұ•жү“еҮ»й”Җе”®вҖңдёүж— вҖқйЈҹе“Ғдё“йЎ№иЎҢеҠЁ
1гҖҒзӣ®ж Үпјҡе®һзҺ°й”Җе”®вҖңдёүж— вҖқгҖҒиҝҮжңҹеҸҳиҙЁйЈҹе“Ғеҹәжң¬жқңз»қпјҢзӣ‘зқЈйЈҹе“Ғз»ҸиҗҘиҖ…еҲҮе®һеұҘиЎҢдё»дҪ“иҙЈд»»пјҢжҠҠеҘҪйЈҹе“Ғиҝӣиҙ§е…ігҖҒй”Җе”®е…іе’ҢйҖҖеёӮе…іпјҢдҝқйҡңе№ҝеӨ§зҫӨдј—йЈҹе“Ғж¶Ҳиҙ№е®үе…ЁгҖӮ
2гҖҒе·ҘдҪңжҺӘж–ҪпјҡйӣҶдёӯејҖеұ•жү“еҮ»й”Җе”®вҖңдёүж— вҖқйЈҹе“Ғдё“йЎ№ж•ҙжІ»иЎҢеҠЁпјҢзӘҒеҮәйЈҹе“ҒдәӨжҳ“еёӮеңәгҖҒжү№еҸ‘еёӮеңәгҖҒйЈҹе“Ғй…ҚйҖҒиҪҰзӯүжү№еҸ‘й…ҚйҖҒйҮҚзӮ№еҚ•дҪҚпјҢзӘҒеҮәзңҒйҷ…ең°еҢәгҖҒз»ҸиҗҘиҖ…д»“еӮЁеңәжүҖгҖҒеҹҺд№Ўз»“еҗҲйғЁзӯүйҮҚзӮ№еңәжүҖпјҢзӘҒеҮәд№іеҲ¶е“ҒгҖҒи°ғе‘іе“ҒгҖҒй…’зұ»гҖҒе©ҙе№је„ҝйЈҹе“ҒгҖҒеӯЈиҠӮжҖ§иҠӮж—ҘжҖ§йЈҹе“ҒзӯүйҮҚзӮ№е“Ғз§ҚпјҢдёҘеҺүжү“еҮ»з»ҸиҗҘдёҚз¬ҰеҗҲйЈҹе“Ғе®үе…Ёж ҮеҮҶгҖҒж— еҗҲжі•жқҘжәҗгҖҒиҝҮжңҹйЈҹе“Ғзҡ„иЎҢдёәгҖӮ
3гҖҒиҙЈд»»еҚ•дҪҚпјҡзңҒйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖгҖҒзңҒе·Ҙе•ҶеұҖгҖӮ
пјҲеӣӣпјүејҖеұ•еӯҰж ЎйЈҹе Ӯдё“йЎ№ж•ҙжІ»
1гҖҒзӣ®ж ҮпјҡејәеҢ–еӯҰж ЎйЈҹе Ӯзӣ‘з®ЎпјҢе°Өе…¶жҳҜеҒҡеҘҪеҶңжқ‘д№үеҠЎж•ҷиӮІеӯҰз”ҹиҗҘе…»ж”№е–„и®ЎеҲ’йЈҹе“Ғе®үе…Ёзӣ‘з®ЎпјҢзқҖйҮҚи§ЈеҶіеҢәеҹҹжҖ§еӯЈиҠӮжҖ§йЈҹе“Ғе®үе…Ёй—®йўҳпјҢжңүж•Ҳйў„йҳІзҫӨдҪ“жҖ§йЈҹзү©дёӯжҜ’дәӢ件еҸ‘з”ҹгҖӮ
2гҖҒе·ҘдҪңжҺӘж–ҪпјҡеҜ№иҫ–еҢәеҶ…еӯҰж Ўеҗ„зұ»йЈҹе ӮиҝӣиЎҢдёҖж¬Ўе…ЁйқўжҺ’жҹҘпјӣеҜ№еӯҰж ЎйЈҹе Ӯд»Һдёҡдәәе‘ҳиҝӣиЎҢзӣёе…іеҹ№и®ӯпјӣеҜ№еҸ‘зҺ°иҪҜ硬件дёҚз¬ҰеҗҲ规е®ҡзҡ„иҰҒзқЈдҝғж•ҙж”№гҖӮ11жңҲдёӯдёӢж—¬пјҢеҜ№еӯҰж ЎйЈҹе Ӯдё“йЎ№ж•ҙжІ»е·ҘдҪңиҝӣиЎҢжҠҪжҹҘ并йҖҡжҠҘгҖӮ
3гҖҒиҙЈд»»еҚ•дҪҚпјҡзңҒйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖ,й…ҚеҗҲеҚ•дҪҚпјҡзңҒж•ҷиӮІеҺ…гҖӮ
пјҲдә”пјүејҖеұ•иҚҜе“ҒвҖңдёӨжү“дёӨе»әвҖқдё“йЎ№иЎҢеҠЁ
1гҖҒзӣ®ж ҮпјҡжүҺе®һејҖеұ•иҚҜе“ҒвҖңдёӨжү“дёӨе»әвҖқдё“йЎ№иЎҢеҠЁпјҲеҚідёҘеҺүжү“еҮ»иҚҜе“Ғиҝқжі•з”ҹдә§гҖҒжү“еҮ»иҚҜе“Ғиҝқжі•з»ҸиҗҘпјҢеҠ ејәиҚҜе“Ғз”ҹдә§з»ҸиҗҘ规иҢғе»әи®ҫе’ҢиҚҜе“Ғзӣ‘з®ЎжңәеҲ¶е»әи®ҫпјүпјҢж·ұжҢ–еёҰжңүеҢәеҹҹжҖ§гҖҒзі»з»ҹжҖ§зү№зӮ№е’ҢвҖңжҪң规еҲҷвҖқжҖ§иҙЁзҡ„иҚҜе“Ғе®үе…ЁйҡҗжӮЈпјҢжҹҘеӨ„дёҖжү№иҝқжі•иҝқ规иЎҢдёәпјҢ移йҖҒдёҖжү№иҝқжі•жЎҲ件пјҢиҝӣдёҖжӯҘ规иҢғиҚҜе“Ғз”ҹдә§з»ҸиҗҘ秩еәҸпјҢе®Ңе–„зӣ‘管规иҢғе’ҢжңәеҲ¶пјҢжҸҗеҚҮиҚҜе“Ғзӣ‘з®Ўж°ҙе№ігҖӮ
2гҖҒе·ҘдҪңжҺӘж–Ҫпјҡй’ҲеҜ№еҪ“еүҚеӯҳеңЁзҡ„зӘҒеҮәй—®йўҳпјҢз»„з»ҮеҘҪиҚҜе“ҒвҖңдёӨжү“дёӨе»әвҖқзҡ„еҮ еңәж”»еқҡжҲҳгҖӮдёҖжҳҜжү“еҮ»иҚҜе“Ғиҝқжі•з”ҹдә§гҖӮд»ҘдёӯиҚҜйўҶеҹҹдёәйҮҚзӮ№пјҢз»„з»ҮејҖеұ•еҜ№дёӯиҚҜжҸҗеҸ–зү©е’ҢдёӯиҚҜйҘ®зүҮз”ҹдә§зҡ„йЈһиЎҢжЈҖжҹҘпјҢеҸ‘зҺ°иҝқжі•иҝқ规问йўҳпјҢдёҘиӮғжҹҘеӨ„гҖӮдәҢжҳҜж•ҙжІ»дәіе·һдёӯиҚҜжқҗеёӮеңәгҖӮдёҘеҺүжү“еҮ»еҲ¶еҒҮе”®еҒҮгҖҒйқһжі•еҠ е·Ҙй”Җе”®дёӯиҚҜжқҗгҖҒдёӯиҚҜйҘ®зүҮзӯүиҝқжі•зҠҜзҪӘиЎҢдёәпјҢеҠ ејәдёӯиҚҜжқҗеёӮеңәз®ЎзҗҶе’Ң规иҢғеҢ–е»әи®ҫгҖӮдёүжҳҜзқҖеҠӣж•ҙжІ»зҪ‘дёҠе”®иҚҜй—®йўҳпјҢжӣқе…үдёҖжү№йқһжі•зҪ‘з«ҷпјҢе…¬еёғдёҖжү№е…ёеһӢжЎҲ件пјҢжү“еҮ»дёҖжү№иҝқжі•иҝқ规иЎҢдёәгҖӮ
3гҖҒиҙЈд»»еҚ•дҪҚпјҡзңҒйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖгҖҒзңҒе…¬е®үеҺ…гҖӮ
дёүгҖҒе®һж–ҪжӯҘйӘӨ
2016е№ҙеә•еүҚпјҢе…ЁзңҒдёҘеҺүжү“еҮ»еҲ¶е”®вҖңдёүж— вҖқйЈҹе“Ғе’ҢеҒҮеҠЈиҚҜе“ҒиЎҢдёәдё“йЎ№иЎҢеҠЁеҸ–еҫ—йҳ¶ж®өжҖ§жҲҗжһңгҖӮдё“йЎ№иЎҢеҠЁеҲҶдёүдёӘйҳ¶ж®өе®һж–Ҫпјҡ第дёҖйҳ¶ж®өпјҢдёәе…ЁйқўжЈҖжҹҘе’ҢдёҘеҺүжү“еҮ»йҳ¶ж®өгҖӮзӘҒеҮәйҮҚзӮ№ең°еҢәгҖҒйҮҚзӮ№е“Ғз§Қе’ҢйҮҚзӮ№еҚ•дҪҚпјҢе…ЁйқўејҖеұ•дё“йЎ№иЎҢеҠЁгҖӮ第дәҢйҳ¶ж®өпјҲ2016е№ҙ12жңҲдёҠж—¬пјүпјҢдёәвҖңдёүж— вҖқйЈҹе“Ғе’ҢеҒҮеҠЈиҚҜе“ҒйӣҶдёӯй”ҖжҜҒйҳ¶ж®өгҖӮз»„з»Үеҗ„ең°еңЁз»ҹдёҖж—¶й—ҙйӣҶдёӯй”ҖжҜҒвҖңдёүж— вҖқйЈҹе“Ғе’ҢеҒҮеҠЈиҚҜе“ҒпјҢеҠ ејәе®Јдј жҠҘйҒ“пјҢиҝӣдёҖжӯҘжү©еӨ§еЈ°еҠҝгҖӮ第дёүйҳ¶ж®өпјҲ2016е№ҙ12жңҲдёӯгҖҒдёӢж—¬пјүпјҢдёәе»әз«Ӣй•ҝж•Ҳзӣ‘з®ЎжңәеҲ¶йҳ¶ж®өгҖӮеҜ№дё“йЎ№иЎҢеҠЁиҝӣиЎҢжҖ»з»“пјҢе»әз«Ӣ并е®Ңе–„еҲ¶еәҰпјҢйҖҗжӯҘе»әз«ӢйЈҹе“ҒиҚҜе“Ғе®үе…Ёзҡ„иҙЈд»»дҪ“зі»гҖҒиҜ„д»·дҪ“зі»гҖҒиҜҡдҝЎдҪ“зі»гҖҒйЈҺйҷ©йҳІжҺ§дҪ“зі»е’ҢзӨҫдјҡзӣ‘зқЈдҪ“зі»пјҢжһ„е»әйЈҹе“ҒиҚҜе“Ғзӣ‘з®Ўзҡ„зӨҫдјҡе…ұжІ»ж јеұҖгҖӮ
еӣӣгҖҒе·ҘдҪңиҰҒжұӮ
пјҲдёҖпјүдёҠдёӢиҒ”еҠЁпјҢйҪҗжҠ“е…ұз®ЎгҖӮе…ЁзңҒдёҘеҺүжү“еҮ»еҲ¶е”®вҖңдёүж— вҖқйЈҹе“Ғе’ҢеҒҮеҠЈиҚҜе“ҒиЎҢдёәдё“йЎ№иЎҢеҠЁз”ұзңҒйЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎеұҖзүөеӨҙиҙҹиҙЈгҖӮзңҒйЈҹе®үеҠһгҖҒзңҒж•ҷиӮІеҺ…гҖҒзңҒе…¬е®үеҺ…гҖҒзңҒеҶң委гҖҒзңҒе·Ҙе•ҶеұҖгҖҒзңҒиҙЁзӣ‘еұҖжҢүз…§гҖҠзңҒдәәж°‘ж”ҝеәңе…ідәҺж”№йқ©е®Ңе–„зңҒзә§йЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶдҪ“еҲ¶зҡ„е®һж–Ҫж„Ҹи§ҒгҖӢе’ҢзңҒйЈҹе®үеҠһгҖҒзңҒе·Ҙе•ҶеұҖгҖҒзңҒиҙЁзӣ‘еұҖгҖҒзңҒйЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎеұҖиҒ”еҗҲдёӢеҸ‘зҡ„гҖҠе…ідәҺеҒҡеҘҪжңәжһ„ж”№йқ©жңҹй—ҙйЈҹе“Ғзӣ‘з®Ўе·ҘдҪңзҡ„йҖҡзҹҘгҖӢпјҲзҡ–йЈҹе®ү委еҠһгҖ”2016пјү59еҸ·пјүиҰҒжұӮе’Ңжң¬ж–№жЎҲжҳҺзЎ®зҡ„иҙЈд»»еҲҶе·ҘпјҢи®ӨзңҹеұҘиҒҢе°ҪиҙЈпјҢеҠ ејәеҚҸдҪңиҒ”еҠЁпјҢеҪўжҲҗе·ҘдҪңеҗҲеҠӣгҖӮдё“йЎ№иЎҢеҠЁеқҡжҢҒжқЎеқ—з»“еҗҲгҖҒдёҠдёӢиҒ”еҠЁзҡ„еҺҹеҲҷгҖӮеҗ„ең°иҰҒиҗҪе®һйЈҹе“ҒиҚҜе“Ғе®үе…Ёеұһең°з®ЎзҗҶиҙЈд»»пјҢеҠ ејәеҜ№иҝҷж¬Ўдё“йЎ№иЎҢеҠЁзҡ„з»„з»ҮйўҶеҜјпјҢз»“еҗҲе®һйҷ…еҲ¶е®ҡе·ҘдҪңж–№жЎҲпјҢжҳҺзЎ®зӣ®ж ҮпјҢз»ҶеҢ–жҺӘж–ҪпјҢзІҫеҝғз»„з»Үе®һж–ҪгҖӮеёӮеҺҝдёӨзә§еңЁйЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎдҪ“еҲ¶ж”№йқ©жңӘе®һж–Ҫд№ӢеүҚд»ҚжҢүзҺ°иЎҢдҪ“еҲ¶пјҢйЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎгҖҒеҶңдёҡгҖҒе·Ҙе•ҶгҖҒиҙЁзӣ‘гҖҒж•ҷиӮІгҖҒе…¬е®үгҖҒе•ҶеҠЎзӯүйғЁй—ЁиҰҒеҗ„иҙҹе…¶иҙЈпјҢзӣёдә’й…ҚеҗҲпјҢеҲҮе®һиҗҪе®һйЈҹе“ҒиҚҜе“Ғзӣ‘з®Ўеҗ„зҺҜиҠӮзҡ„зӣ‘з®ЎиҙЈд»»пјҢзЎ®дҝқйЈҹе“ҒиҚҜе“Ғе®үе…ЁгҖӮ
пјҲдәҢпјүеҠ ејәиЎҢеҲ‘иЎ”жҺҘгҖӮеҗ„ең°еҗ„зӣёе…ійғЁй—ЁиҰҒи®ӨзңҹиҙҜеҪ»гҖҠжңҖй«ҳдәәж°‘жі•йҷўгҖҒжңҖй«ҳдәәж°‘жЈҖеҜҹйҷўе…ідәҺеҠһзҗҶеҚұе®ійЈҹе“Ғе®үе…ЁеҲ‘дәӢжЎҲ件йҖӮз”Ёжі•еҫӢиӢҘе№Ій—®йўҳзҡ„и§ЈйҮҠгҖӢгҖҒгҖҠеҲ‘жі•дҝ®жӯЈжЎҲпјҲе…«пјүгҖӢе’ҢгҖҠжңҖй«ҳдәәж°‘жі•йҷўгҖҒжңҖй«ҳдәәж°‘жЈҖеҜҹйҷўе…ідәҺеҠһзҗҶз”ҹдә§гҖҒй”Җе”®еҒҮиҚҜгҖҒеҠЈиҚҜеҲ‘дәӢжЎҲ件具дҪ“еә”з”Ёжі•еҫӢиӢҘе№Ій—®йўҳзҡ„и§ЈйҮҠгҖӢзҡ„规е®ҡпјҢеҒҡеҘҪйЈҹе“ҒиҚҜе“ҒиЎҢж”ҝжү§жі•дёҺеҲ‘дәӢеҸёжі•иЎ”жҺҘе·ҘдҪңпјҢдёҘеҺүжү“еҮ»йЈҹе“ҒиҚҜе“Ғиҝқжі•зҠҜзҪӘжҙ»еҠЁпјҢзЎ®дҝқеҜ№зҠҜзҪӘеҲҶеӯҗзҡ„еҲ‘дәӢиҙЈд»»иҝҪ究еҲ°дҪҚгҖӮеҗ„ең°гҖҒеҗ„зӣёе…ійғЁй—ЁиҰҒеӨ§еј ж——йј“ең°з»„з»ҮеҜ№иҝқжі•зҠҜзҪӘеҲҶеӯҗзҡ„е…¬ејҖе®ЈеҲӨпјҢеҪўжҲҗйңҮж‘„еҠӣйҮҸгҖӮ
пјҲдёүпјүе»әз«ӢйЈҹе“ҒиҚҜе“Ғе®үе…ЁдҝЎз”Ёе’ҢвҖңй»‘еҗҚеҚ•вҖқеҲ¶еәҰгҖӮеҠ еҝ«е»әз«Ӣеҗ„зұ»йЈҹе“ҒиҚҜе“Ғз”ҹдә§з»ҸиҗҘеҚ•дҪҚйЈҹе“ҒиҚҜе“Ғе®үе…ЁдҝЎз”ЁжЎЈжЎҲпјҢе®Ңе–„жү§жі•жЈҖжҹҘи®°еҪ•пјҢж №жҚ®дҝЎз”Ёзӯүзә§е®һж–ҪеҲҶзұ»зӣ‘з®ЎпјҢзқЈдҝғйЈҹе“ҒиҚҜе“Ғз”ҹдә§з»ҸиҗҘиҖ…иҗҪе®һйЈҹе“ҒиҚҜе“Ғе®үе…Ёзҡ„дё»дҪ“иҙЈд»»гҖӮе»әз«ӢеӨұдҝЎжғ©жҲ’еҲ¶еәҰпјҢеҠ ејәеҜ№жңүдёҚиүҜдҝЎз”Ёзҡ„йЈҹе“ҒиҚҜе“Ғз”ҹдә§з»ҸиҗҘеҚ•дҪҚзҡ„зӣ‘з®ЎпјҢеҜ№дёҘйҮҚиҝқеҸҚжі•еҫӢ法规зҡ„еҚ•дҪҚе’ҢдёӘдәәеҲ—е…ҘвҖңй»‘еҗҚеҚ•вҖқпјҢйҖҡиҝҮж–°й—»еӘ’дҪ“жҲ–иҖ…зҪ‘з»ңеҗ‘зӨҫдјҡдәҲд»Ҙе…¬еёғгҖӮ
пјҲеӣӣпјүжһ„е»әзӨҫдјҡе…ұжІ»ж јеұҖгҖӮеҗ„ең°иҰҒй«ҳеәҰйҮҚи§ҶйЈҹе“ҒиҚҜе“Ғе®үе…ЁиЎҢдёҡиҮӘеҫӢгҖҒдҝЎз”Ёе»әи®ҫгҖҒйҒ“еҫ·е»әи®ҫе’ҢзӨҫдјҡзӣ‘зқЈжңәеҲ¶е»әи®ҫпјҢе……еҲҶеҸ‘жҢҘдјҒдёҡгҖҒеёӮеңәгҖҒдёӯд»Ӣжңәжһ„гҖҒзӨҫдјҡз»„з»ҮгҖҒж¶Ҳиҙ№иҖ…гҖҒж–°й—»еӘ’дҪ“зӯүеҗ„ж–№йқўзҡ„з§ҜжһҒжҖ§пјҢеҪўжҲҗе…ЁзӨҫдјҡйҪҗжҠ“е…ұз®Ўзҡ„еҗҲеҠӣпјҢз§ҜжһҒжһ„е»әдјҒдёҡиҮӘеҫӢгҖҒж”ҝеәңзӣ‘з®ЎгҖҒзӨҫдјҡеҚҸеҗҢгҖҒе…¬дј—еҸӮдёҺгҖҒжі•еҲ¶дҝқйҡңзҡ„йЈҹе“ҒиҚҜе“Ғе®үе…ЁзӨҫдјҡе…ұжІ»зҡ„ж јеұҖгҖӮ
е…ЁзңҒдёҘеҺүжү“еҮ»еҲ¶е”®вҖңдёүж— вҖқйЈҹе“Ғе’ҢеҒҮеҠЈиҚҜе“ҒиЎҢдёәдё“йЎ№иЎҢеҠЁе®һж–Ҫе·ҘдҪңиҝӣеұ•жңҲжҠҘе‘ҠеҲ¶еәҰгҖӮеҗ„и®ҫеҢәзҡ„еёӮе’ҢзңҒзӣҙеҗ„жңүе…ійғЁй—ЁзЎ®е®ҡдёҖеҗҚиҒ”з»ңе‘ҳпјҢдәҺжҜҸжңҲ25ж—ҘеүҚе°Ҷжң¬ең°жң¬йғЁй—Ёдё“йЎ№иЎҢеҠЁиҝӣеұ•жғ…еҶөжҠҘйҖҒзңҒйЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎеұҖгҖӮ2016е№ҙ12жңҲ20ж—ҘеүҚе°Ҷжң¬ең°гҖҒжң¬йғЁй—Ёдё“йЎ№иЎҢеҠЁжҖ»з»“жҠҘйҖҒзңҒйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖгҖӮ
第4зҜҮдёҖгҖҒеҠ ејәйўҶеҜјпјҢиҗҪе®һзӣ‘з®ЎиҙЈд»»
вҖңдёӨиҠӮвҖқжңҹй—ҙжҳҜйӨҗйҘ®ж¶Ҳиҙ№зҡ„й«ҳеі°ж—¶ж®өпјҢд№ҹжҳҜйЈҹе“Ғе®үе…ЁйЈҺйҷ©йӣҶдёӯгҖҒй—®йўҳжҳ“еҸ‘зҡ„ж•Ҹж„ҹж—¶ж®өгҖӮеҲҮе®һеҒҡеҘҪвҖңдёӨиҠӮвҖқжңҹй—ҙйӨҗйҘ®е®үе…Ёе·ҘдҪңпјҢеҜ№дәҺдҝқйҡңдәәж°‘зҫӨдј—еәҰиҝҮж¬ўд№җзҘҘе’Ңзҡ„иҠӮж—ҘпјҢз»ҙжҠӨзӨҫдјҡе’Ңи°җзЁіе®ҡпјҢе…·жңүйҮҚиҰҒж„Ҹд№үгҖӮеҗ„йӨҗйҘ®е®үе…Ёзӣ‘з®ЎеҚ•дҪҚиҰҒиҝӣдёҖжӯҘеўһејәж”ҝжІ»ж„ҸиҜҶгҖҒиҙЈд»»ж„ҸиҜҶгҖҒеӨ§еұҖж„ҸиҜҶпјҢжҠҠеҠ ејәвҖңдёӨиҠӮвҖқжңҹй—ҙйӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…Ёзӣ‘з®ЎгҖҒйҳІжҺ§йӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…ЁдәӢж•…дҪңдёәдёҖ件еӨ§дәӢжқҘжҠ“пјҢеҠ ејәз»„з»ҮйўҶеҜјгҖӮиҰҒй’ҲеҜ№иҠӮж—Ҙжңҹй—ҙйӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…Ёзҡ„зү№зӮ№пјҢеҸҠж—©и®ЎеҲ’пјҢ科еӯҰйғЁзҪІпјҢи®Өзңҹз»„з»Үе®һж–ҪгҖӮеҲҮе®һиҗҪе®һйЈҹе“Ғе®үе…Ёзӣ‘з®ЎиҙЈд»»гҖӮ
дәҢгҖҒзӘҒеҮәйҮҚзӮ№пјҢдёҘж јиҗҪе®һеҗ„йЎ№зӣ‘з®ЎжҺӘж–Ҫ
еҗ„йӨҗйҘ®йЈҹе“Ғе®үе…Ёзӣ‘з®ЎеҚ•дҪҚиҰҒзӘҒеҮәйҮҚзӮ№пјҢй’ҲеҜ№вҖңдёӨиҠӮвҖқжңҹй—ҙеәҶзҘқжҙ»еҠЁе’Ңе…¬дј—еҮәжёёгҖҒиҒҡйӨҗжҙ»еҠЁеӨҡзҡ„жғ…еҶөпјҢд»ҘйӨҗйҘ®йӣҶдёӯеҢәгҖҒж—…жёёжҷҜеҢәзӯүдёәйҮҚзӮ№еҢәеҹҹпјҢд»ҘеҶңжқ‘гҖҒеӯҰж ЎпјҲеҗ«жүҳе№јжңәжһ„пјүйЈҹе ӮгҖҒе»әзӯ‘е·Ҙең°йЈҹе ӮеҸҠиҠӮж—Ҙжңҹй—ҙжүҝеҠһеӨ§еһӢиҒҡйӨҗзҡ„йӨҗйҘ®жңҚеҠЎеҚ•дҪҚгҖҒж—…жёёжҷҜеҢәеҸҠе‘Ёиҫ№йӨҗйҘ®жңҚеҠЎеҚ•дҪҚгҖҒе°ҸйӨҗйҘ®гҖҒеҶң家д№җгҖҒйӣҶдҪ“з”ЁйӨҗй…ҚйҖҒеҚ•дҪҚзӯүдёәйҮҚзӮ№еҚ•дҪҚпјҢд»ҘйӨҗйҘ®жңҚеҠЎеҚ•дҪҚиҮӘеҲ¶жңҲйҘјгҖҒеҶ·иҚӨеҮүиҸңгҖҒиЈұиҠұиӣӢзі•гҖҒиӮүеҸҠиӮүеҲ¶е“ҒзӯүиҠӮж—Ҙж¶Ҳиҙ№е“Ғз§ҚдёәйҮҚзӮ№е“Ғз§ҚпјҢд»ҘйЈҹе“ҒеҺҹж–ҷзҙўзҘЁзҙўиҜҒгҖҒйЈҹе“ҒеҠ е·Ҙж“ҚдҪңгҖҒйӨҗйҘ®е…·жё…жҙ—ж¶ҲжҜ’гҖҒйЈҹе“Ғи—ҸеӮЁи®ҫж–Ҫи®ҫеӨҮгҖҒйЈҹе“Ғж·»еҠ еүӮз®ЎзҗҶе’ҢдҪҝз”ЁгҖҒйЈҹе“Ғз•ҷж ·зӯүдёәйҮҚзӮ№зҺҜиҠӮпјҢеҠ еӨ§зӣ‘зқЈжЈҖжҹҘзӣ‘жөӢеҠӣеәҰгҖӮзқЈдҝғеҗ„зұ»йӨҗйҘ®жңҚеҠЎжҸҗдҫӣиҖ…еҲҮе®һиҗҪе®һйЈҹе“Ғе®үе…Ёдё»дҪ“иҙЈд»»пјҢдёҘж јжү§иЎҢгҖҠйӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…Ёж“ҚдҪң规иҢғгҖӢе’ҢгҖҠйӨҗйҘ®жңҚеҠЎйЈҹе“ҒйҮҮиҙӯзҙўиҜҒзҙўзҘЁз®ЎзҗҶ规е®ҡгҖӢпјҢзЎ®дҝқйӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…ЁгҖӮеҗҢж—¶пјҢиҰҒзү№еҲ«еҠ ејәеҜ№еҶңжқ‘зҫӨдҪ“жҖ§иҒҡйӨҗзӯүжҙ»еҠЁзҡ„зӣ‘зқЈжҢҮеҜјпјҢдёҘйҳІиҠӮж—Ҙжңҹй—ҙйӣҶдҪ“йЈҹзү©дёӯжҜ’дәӢ件зҡ„еҸ‘з”ҹгҖӮ
дёүгҖҒдёҘж јжү§жі•пјҢжҹҘеӨ„иҝқжі•иЎҢдёә
еҗ„йӨҗйҘ®йЈҹе“Ғе®үе…Ёзӣ‘з®ЎеҚ•дҪҚеҜ№зӣ‘зқЈжЈҖжҹҘдёӯеҸ‘зҺ°зҡ„е’ҢзҫӨдј—дёҫжҠҘзҡ„йӨҗйҘ®жңҚеҠЎеҚ•дҪҚзҡ„иҝқжі•иҝқ规иЎҢдёәпјҢиҰҒи®ӨзңҹгҖҒеҸҠж—¶иҝӣиЎҢи°ғжҹҘеҸ–иҜҒпјҢдёҘж јдҫқжі•жҹҘеӨ„гҖӮдёҘеҺүжү“еҮ»ж·»еҠ йқһйЈҹз”Ёзү©иҙЁе’Ңж»Ҙз”ЁйЈҹе“Ғж·»еҠ еүӮзҡ„иҝқжі•иЎҢдёәпјҢж¶үе«ҢзҠҜзҪӘзҡ„пјҢдёҖеҫӢ移йҖҒе…¬е®үжңәе…ігҖӮ
еӣӣгҖҒжңүж•Ҳеә”еҜ№пјҢејәеҢ–еә”жҖҘеӨ„зҪ®
еҗ„зӣ‘з®ЎеҚ•дҪҚиҰҒдёҘж јжҢүз…§жҲ‘еёӮйЈҹе“Ғе®үе…ЁдәӢж•…еә”жҖҘйў„жЎҲиҰҒжұӮпјҢеҒҡеҘҪйӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…ЁдәӢж•…зҡ„йҳІиҢғе’Ңеә”жҖҘеӨ„зҪ®е·ҘдҪңгҖӮи®ӨзңҹжЈҖжҹҘйӨҗйҘ®жңҚеҠЎеҚ•дҪҚйЈҹе“Ғе®үе…Ёеә”жҖҘеӨ„зҪ®еҲ¶еәҰзҡ„иҗҪе®һжғ…еҶөпјҢдёҘеҜҶжҺ’жҹҘ并ж¶ҲйҷӨйЈҹе“Ғе®үе…ЁдәӢж•…йҡҗжӮЈгҖӮвҖңдёӨиҠӮвҖқжңҹй—ҙиҰҒдёҘж јжү§иЎҢ24е°Ҹж—¶еҖјзҸӯеҲ¶еәҰе’ҢйўҶеҜјеёҰзҸӯеҖјзҸӯеҲ¶еәҰпјҢ科еӯҰе®үжҺ’дәәе‘ҳдј‘еҒҮе’ҢеҖје®ҲпјҢеҒҡеҘҪйЈҹе“Ғе®үе…ЁдәӢ件зҡ„еә”еҜ№еҮҶеӨҮе·ҘдҪңгҖӮиҰҒдҝқжҢҒй«ҳеәҰж•Ҹж„ҹжҖ§пјҢеқҡеҶіе…ӢжңҚйә»з—№жқҫжҮҲжҖқжғіпјҢеҜҶеҲҮе…іжіЁиҲҶжғ…еҠЁжҖҒпјҢдҝқжҢҒйҖҡи®ҜиҒ”з»ңз•…йҖҡгҖӮзЎ®дҝқдёҖж—ҰеҸ‘з”ҹйЈҹе“Ғе®үе…Ёй—®йўҳпјҢиғҪеӨҹеңЁз¬¬дёҖж—¶й—ҙз»„з»Үж ёжҹҘеӨ„зҗҶпјҢдҝқиҜҒеҒҡеҲ°еҸҚеә”зҒөж•ҸгҖҒе“Қеә”иҝ…йҖҹгҖҒеӨ„зҪ®жңүж•ҲпјҢ并еҸҠж—¶жҢү规е®ҡдёҠжҠҘпјҢдёҚеҫ—зһ’жҠҘгҖҒиҝҹжҠҘгҖӮ
дә”гҖҒе№ҝжіӣе®Јдј пјҢиҗҘйҖ иүҜеҘҪж°ӣеӣҙ
еҗ„йӨҗйҘ®е®үе…Ёзӣ‘з®ЎеҚ•дҪҚиҰҒжҠ“дҪҸвҖңдёӨиҠӮвҖқжңҹй—ҙжңүеҲ©ж—¶жңәпјҢйҖҡиҝҮж–°й—»еӘ’дҪ“зӯүеӨҡз§ҚеҪўејҸпјҢеӨ§еҠӣејҖеұ•йЈҹе“Ғе®үе…ЁгҖҒиҜҡдҝЎз»ҸиҗҘе’ҢиҒҢдёҡйҒ“еҫ·е®Јдј ж•ҷиӮІпјҢејәеҢ–йӨҗйҘ®жңҚеҠЎеҚ•дҪҚзҡ„йЈҹе“Ғе®үе…Ёж„ҸиҜҶгҖҒиҜҡдҝЎз»ҸиҗҘж„ҸиҜҶпјҢд»ҘиҠӮж—ҘйЈҹе“ҒдёәйҮҚзӮ№жңүй’ҲеҜ№жҖ§ең°жҷ®еҸҠйЈҹе“Ғе®үе…ЁзҹҘиҜҶпјҢеўһејәж¶Ҳиҙ№иҖ…зҡ„йЈҹе“Ғе®үе…Ёж„ҸиҜҶе’ҢиҮӘжҲ‘дҝқжҠӨиғҪеҠӣпјҢдёәйӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…Ёзӣ‘з®Ўе·ҘдҪңиҗҘйҖ иүҜеҘҪзҡ„зӨҫдјҡж°ӣеӣҙгҖӮиҰҒеҜҶеҲҮдёҺж–°й—»еӘ’дҪ“зҡ„иҒ”зі»пјҢејәеҢ–жӯЈйқўе®Јдј пјҢеҝ«йҖҹзЁіеҰҘеӨ„зҗҶеӘ’дҪ“еҸ‘зҺ°зҡ„й—®йўҳпјҢдёҘйҳІеҮәзҺ°зӮ’дҪңзғӯзӮ№гҖӮ
第5зҜҮдёҖгҖҒе·ҘдҪңзӣ®ж Ү
жң¬ж¬Ўдё“йЎ№иЎҢеҠЁд»ҘдёҘеҺүжү“еҮ»иҚҜе“Ғиҝқжі•з”ҹдә§гҖҒдёҘеҺүжү“еҮ»иҚҜе“Ғиҝқжі•з»ҸиҗҘгҖҒеҠ ејәиҚҜе“Ғз”ҹдә§з»ҸиҗҘ规иҢғе»әи®ҫе’ҢеҠ ејәиҚҜе“Ғзӣ‘з®ЎжңәеҲ¶е»әи®ҫдёәдё»иҰҒеҶ…е®№пјҢеқҡжҢҒжү“еҮ»дёҺ规иҢғзӣёз»“еҗҲпјҢйӣҶдёӯеҚҠе№ҙзҡ„ж—¶й—ҙпјҢй’ҲеҜ№еҪ“еүҚеӯҳеңЁзҡ„зӘҒеҮәй—®йўҳпјҢж·ұжҢ–еёҰжңүеҢәеҹҹжҖ§гҖҒзі»з»ҹжҖ§зү№зӮ№е’ҢвҖңжҪң规еҲҷвҖқжҖ§иҙЁзҡ„иҚҜе“Ғе®үе…ЁйҡҗжӮЈпјҢжҹҘеӨ„дёҖжү№иҝқжі•иҝқ规иЎҢдёәпјҢ移йҖҒдёҖжү№иҝқжі•жЎҲ件пјҢиҝӣдёҖжӯҘ规иҢғиҚҜе“Ғз”ҹдә§з»ҸиҗҘ秩еәҸпјҢе®Ңе–„зӣ‘管规иҢғе’ҢжңәеҲ¶пјҢжҸҗеҚҮиҚҜе“Ғзӣ‘з®Ўж°ҙе№іпјҢи®©дәәж°‘зҫӨдј—з”ЁиҚҜжӣҙеҠ е®үе…Ёжңүж•ҲгҖӮ
дәҢгҖҒвҖңдёӨжү“вҖқе·ҘдҪңйҮҚзӮ№
пјҲдёҖпјүиҚҜе“Ғз”ҹдә§зҺҜиҠӮйҮҚзӮ№жү“еҮ»иЎҢдёә
1гҖҒдёӯиҚҜдјҒдёҡиҝқжі•иЎҢдёә
пјҲ1пјүдёӯжҲҗиҚҜз”ҹдә§дјҒдёҡд»Һйқһжі•жё йҒ“иҙӯз”ЁжҸҗеҸ–зү©з”ҹдә§иҚҜе“Ғпјӣ
пјҲ2пјүдёӯжҲҗиҚҜз”ҹдә§дјҒдёҡдёҚдёҘж јжҢү照规е®ҡзҡ„еӨ„ж–№е·Ҙиүәз”ҹдә§жҲ–委жүҳз”ҹдә§жҸҗеҸ–зү©пјӣ
пјҲ3пјүдёӯжҲҗиҚҜз”ҹдә§дјҒдёҡдҪҝз”ЁеҒҮеҶ’дјӘеҠЈдёӯиҚҜжқҗгҖҒдёӯиҚҜжқҗйқһиҚҜз”ЁйғЁдҪҚе’Ңиў«жұЎжҹ“жҲ–жҸҗеҸ–иҝҮзҡ„дёӯиҚҜжқҗз”ҹдә§иҚҜе“Ғпјӣ
пјҲ4пјүдёӯиҚҜйҘ®зүҮз”ҹдә§дјҒдёҡдҪҝз”ЁеҒҮеҶ’дјӘеҠЈе’ҢеўһйҮҚжҹ“иүІдёӯиҚҜжқҗгҖҒдёӯиҚҜжқҗйқһиҚҜз”ЁйғЁдҪҚе’Ңиў«жұЎжҹ“жҲ–жҸҗеҸ–иҝҮзҡ„дёӯиҚҜжқҗз”ҹдә§дёӯиҚҜйҘ®зүҮпјӣ
пјҲ5пјүдёӯиҚҜйҘ®зүҮдјҒдёҡеӨ–иҙӯйқһжі•еҠ е·Ҙзҡ„дёӯиҚҜйҘ®зүҮж”№жҚўеҢ…иЈ…ж Үзӯҫй”Җе”®пјӣ
2гҖҒеҢ–еӯҰиҚҜе“Ғиҝқжі•з”ҹдә§иЎҢдёә
пјҲ1пјүдҪҝз”ЁеҢ–е·ҘеҺҹж–ҷгҖҒйқһжі•еҢ…иЈ…жқҗж–ҷе’ҢдёҚз¬ҰеҗҲиҚҜз”ЁиҰҒжұӮзҡ„иҫ…ж–ҷз”ҹдә§иҚҜе“Ғпјӣ
пјҲ2пјү委жүҳж— иө„иҙЁдјҒдёҡз”ҹдә§иҚҜе“Ғе’ҢжҺҘеҸ—ж— иө„иҙЁдјҒдёҡ委жүҳз”ҹдә§иҚҜе“Ғпјӣ
пјҲ3пјүжңӘз»Ҹжү№еҮҶ委жүҳз”ҹдә§иҚҜе“Ғпјӣ
пјҲ4пјү委жүҳз”ҹдә§ж— еҢ…иЈ…дә§е“Ғпјӣ

пјҲ5пјүеҸ—委жүҳдјҒдёҡдёҚдёҘж јжҢү规е®ҡеӨ„ж–№е·Ҙиүәз”ҹдә§иҚҜе“ҒпјҢ委жүҳз”ҹдә§иҚҜе“ҒиҙЁйҮҸдёҚз¬ҰеҗҲ规е®ҡзҡ„гҖӮ
пјҲдәҢпјүдёӯиҚҜжқҗеёӮеңәйҮҚзӮ№жү“еҮ»иЎҢдёә
1гҖҒй”Җе”®жҹ“иүІеўһйҮҚгҖҒжҺәжқӮдҪҝеҒҮзӯүеҒҮеҠЈдёӯиҚҜжқҗпјӣ
2гҖҒиҚҜжёЈеәҹж–ҷеӣһжөҒеёӮеңәпјӣ
3гҖҒй”Җе”®дёӯиҚҜйҘ®зүҮгҖҒдёӯжҲҗиҚҜжҲ–еҢ–еӯҰиҚҜе“Ғпјӣ
4гҖҒй”Җе”®жҜ’жҖ§иҚҜжқҗгҖҒдҝқжҠӨеҠЁжӨҚзү©еҲ¶е“ҒгҖӮ
пјҲдёүпјүиҚҜе“Ғз»ҸиҗҘзҺҜиҠӮйҮҚзӮ№жү“еҮ»иЎҢдёә
1гҖҒзҪ‘дёҠиҝқжі•е”®иҚҜиЎҢдёәгҖӮ
пјҲ1пјүзҪ‘дёҠй”Җе”®еҒҮеҠЈиҚҜе“ҒжҲ–д»ҘйқһиҚҜе“ҒеҶ’е……иҚҜе“Ғй”Җе”®пјӣ
пјҲ2пјүе·ІеҸ–еҫ—дә’иҒ”зҪ‘иҚҜе“ҒдҝЎжҒҜжңҚеҠЎжҲ–иҚҜе“ҒдәӨжҳ“иө„иҙЁдјҒдёҡпјҢеҸ‘еёғиҷҡеҒҮиҚҜе“ҒдҝЎжҒҜе’Ңиҝқжі•иҚҜе“Ғй”Җе”®иЎҢдёәпјӣ
пјҲ3пјүжңӘеҸ–еҫ—иө„ж јпјҢйқһжі•д»ҺдәӢиҚҜе“Ғй”Җе”®зҡ„зҪ‘з«ҷгҖӮ
2гҖҒиҚҜе“Ғжү№еҸ‘дјҒдёҡиҝқжі•иЎҢдёәгҖӮ
пјҲ1пјүеҮәз§ҹгҖҒеҮәеҖҹдјҒдёҡиө„иҙЁжҲ–жҺҘеҸ—жҢӮйқ з»ҸиҗҘпјҢеҶ’ејҖгҖҒиҷҡејҖеҸ‘зҘЁе’ҢдҪҝз”ЁиҷҡеҒҮеҸ‘зҘЁзӯүиҝқжі•еҪўдёәпјӣ
пјҲ2пјүд»ҺдёҚе…·жңүеҗҲжі•иө„иҙЁзҡ„дјҒдёҡжҲ–иҖ…дёӘдәәзӯүйқһжі•жё йҒ“иҙӯд№°иҚҜе“ҒиЎҢдёәпјӣгҖҗдёүжҳҜзӘҒеҮәйҮҚзӮ№,иҰҶзӣ–е…ЁйқўгҖӮз»“еҗҲе…·дҪ“еҢ»з–—еҷЁжў°жҠҪжЈҖе“Ғз§Қе’ҢжҲ‘иҫ–еҢәе®һйҷ…жғ…еҶө,гҖӮгҖ‘
пјҲ3пјүе°ҶиҚҜе“Ғй”Җе”®з»ҷжңӘеҸ–еҫ—еҗҲжі•иө„иҙЁзҡ„дјҒдёҡе’ҢдҪҝз”ЁеҚ•дҪҚгҖӮ
3гҖҒиҜҠжүҖйқһжі•иҚҜе“Ғиҙӯй”ҖиЎҢдёәгҖӮ
пјҲ1пјүиҝқжі•й…ҚеҲ¶е’ҢдҪҝз”ЁеҢ»з–—жңәжһ„еҲ¶еүӮпјӣ
пјҲ2пјүд»Һйқһжі•жё йҒ“иҙӯиҝӣиҚҜе“Ғпјӣ
пјҲ3пјүиҙӯй”ҖеҒҮеҠЈгҖҒиҝҮжңҹиҚҜе“ҒгҖӮ
пјҲеӣӣпјүеҲҮе®һжҸҗй«ҳвҖңдёӨжү“вҖқеЁҒж…‘еҠӣ
1гҖҒеҜ№иҙЁйҮҸеҸҜз–‘е“Ғз§ҚеқҡеҶідәҲд»ҘжҠҪжЈҖгҖӮе……еҲҶеҸ‘жҢҘзӣ‘жЈҖз»“еҗҲеңЁдё“йЎ№иЎҢеҠЁдёӯзҡ„жү“еҒҮжІ»еҠЈдҪңз”ЁпјҢй’ҲеҜ№еҸҜиғҪеӯҳеңЁй—®йўҳзҡ„е“Ғз§ҚпјҢеҸҜд»Ҙз”ЁгҖҠдёӯеӣҪиҚҜе…ёгҖӢ规е®ҡзҡ„жі•е®ҡжЈҖйӘҢж–№жі•жЈҖйӘҢпјҢд№ҹеҸҜд»Ҙз”ЁеӣҪ家йЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎйғЁй—Ёжү№еҮҶзҡ„иЎҘе……жЈҖйӘҢж–№жі•жЈҖйӘҢгҖӮиҚҜе“ҒжЈҖйӘҢжңәжһ„еҝ…йЎ»й«ҳж•ҲгҖҒеҝ«йҖҹејҖеұ•ж ·е“ҒжЈҖйӘҢпјҢиҝ…йҖҹеҮҶзЎ®жүҫеҲ°й—®йўҳе’ҢзәҝзҙўпјҢдёәз«ӢжЎҲжҹҘеӨ„жҸҗдҫӣиҜҒжҚ®ж”ҜжҢҒгҖӮеҗҢж—¶пјҢж”ҜжҢҒеҗ„зә§иҚҜе“ҒжЈҖйӘҢжңәжһ„жҺўзҙўз ”究иҚҜе“Ғйқһж ҮжЈҖйӘҢж–№жі•пјҢжӣҙеҘҪең°жҢ–еҮәйҡҗи—Ҹзҡ„иҙЁйҮҸй—®йўҳгҖӮ
2гҖҒеҜ№иҝқжі•иҝқ规иЎҢдёәеқҡеҶідәҲд»Ҙжү“еҮ»гҖӮеҜ№зӣ‘зқЈжЈҖжҹҘдёӯеҸ‘зҺ°зҡ„й—®йўҳпјҢдёҘж јжҢүз…§гҖҠдёӯеҚҺдәәж°‘е…ұе’ҢеӣҪиҚҜе“Ғз®ЎзҗҶжі•гҖӢе’ҢгҖҠеӣҪеҠЎйҷўе…ідәҺеҠ ејәйЈҹе“Ғзӯүдә§е“Ғе®үе…Ёзӣ‘зқЈз®ЎзҗҶзҡ„зү№еҲ«и§„е®ҡгҖӢд»ҺдёҘеӨ„зҪҡпјҢзӣҙиҮіеҗҠй”ҖгҖҠиҚҜе“Ғз”ҹдә§и®ёеҸҜиҜҒгҖӢжҲ–гҖҠиҚҜе“Ғз»ҸиҗҘи®ёеҸҜиҜҒгҖӢгҖӮеҜ№еҗ„ең°жҹҘеҠһзҡ„йҮҚеӨ§жЎҲ件пјҢзңҒеұҖиҝӣиЎҢжҢӮзүҢзқЈеҠһпјӣеҜ№жҹҘиҺ·зҡ„еҒҮеҠЈиҚҜе“ҒпјҢдёҖеҫӢз«ӢеҚіжҹҘе°ҒжүЈжҠјпјҢеқҡеҶідҫқжі•еӨ„зҗҶгҖӮеҗҢж—¶и®ӨзңҹиҙҜеҪ»жү§иЎҢгҖҠдёӯеҚҺдәәж°‘е…ұе’ҢеӣҪеҲ‘жі•дҝ®жӯЈжЎҲпјҲе…«пјүгҖӢе’ҢжңҖй«ҳдәәж°‘жі•йҷўгҖҒжңҖй«ҳдәәж°‘жЈҖеҜҹйҷўгҖҠе…ідәҺеҠһзҗҶз”ҹдә§гҖҒй”Җе”®еҒҮиҚҜгҖҒеҠЈиҚҜеҲ‘дәӢжЎҲ件具дҪ“еә”з”Ёжі•еҫӢиӢҘе№Ій—®йўҳзҡ„и§ЈйҮҠгҖӢпјҢеҒҡеҘҪиҚҜе“ҒиЎҢж”ҝжү§жі•дёҺеҲ‘дәӢеҸёжі•иЎ”жҺҘе·ҘдҪңпјҢз§ҜжһҒиҒ”еҗҲе…¬е®үжңәе…іејҖеұ•жү“еҮ»йқһжі•з”ҹдә§е’Ңз»ҸиҗҘиҚҜе“ҒиЎҢеҠЁпјҢеҸҠж—¶е°Ҷж¶үе«Ңжһ„жҲҗзҠҜзҪӘзҡ„жЎҲ件移дәӨе…¬е®үжңәе…іеӨ„зҗҶгҖӮ
3гҖҒеҜ№иҝқжі•иҝқ规иЎҢдёәеқҡеҶідәҲд»Ҙжӣқе…үгҖӮзңҒеұҖе°Ҷдё»еҠЁжӣқе…үеҗ„ең°жҹҘеӨ„зҡ„иҝқжі•иҝқ规иЎҢдёәпјӣеұһдёҘйҮҚиҝқжі•жЎҲ件зҡ„пјҢе°Ҷз”ұжҖ»еұҖиҝӣиЎҢжӣқе…үгҖӮеҜ№дәҺдёҘйҮҚиҝқеҸҚжі•еҫӢ法规зҡ„дјҒдёҡе’ҢдёӘдәәпјҢдёҖеҫӢеҲ—е…ҘвҖңй»‘еҗҚеҚ•вҖқ并еҜ№зӨҫдјҡе…¬ејҖгҖӮеҜ№еҲ—е…ҘвҖңй»‘еҗҚеҚ•вҖқзҡ„дјҒдёҡпјҢе°ҶеҒңжӯўеҸ—зҗҶе…¶з”іжҠҘзҡ„иҚҜе“ҒиЎҢж”ҝи®ёеҸҜдәӢйЎ№пјҢ并еҠ еӨ§еҜ№е…¶зӣ‘зқЈжЈҖжҹҘзҡ„йў‘ж¬Ўе’ҢеҠӣеәҰгҖӮеҜ№еҲ—е…ҘвҖңй»‘еҗҚеҚ•вҖқзҡ„дёӘдәәпјҢдҫқжі•е®һиЎҢиЎҢдёҡзҰҒе…ҘпјҢеңЁи§„е®ҡж—¶йҷҗеҶ…жңүе…ідәәе‘ҳдёҚеҫ—д»ҺдәӢзӣёе…ідә§е“Ғз”ҹдә§з»ҸиҗҘжҙ»еҠЁпјӣжғ…иҠӮдёҘйҮҚзҡ„пјҢз»Ҳиә«дёҚеҫ—еҶҚд»ҺдәӢиҚҜе“Ғз”ҹдә§з»ҸиҗҘжҙ»еҠЁгҖӮ
4гҖҒеҜ№й—®йўҳдә§е“ҒеқҡеҶідәҲд»ҘеҸ¬еӣһгҖӮеҜ№еҸ‘зҺ°иҚҜе“ҒеҮәзҺ°иҙЁйҮҸзјәйҷ·зҡ„пјҢиҚҜе“Ғз”ҹдә§дјҒдёҡеә”з«ӢеҚіеҒңжӯўдә§е“Ғй”Җе”®пјҢжҺ§еҲ¶еёӮеңәжөҒйҖҡдә§е“ҒгҖҒйҖҡзҹҘдҪҝз”ЁеҚ•дҪҚеҒңжӯўдҪҝз”ЁпјҢдё»еҠЁеҸ¬еӣһй—®йўҳдә§е“ҒпјҢ并еҸҠж—¶й”ҖжҜҒпјҢеҸ¬еӣһжғ…еҶөеҝ…йЎ»жҠҘе‘ҠйЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎйғЁй—ЁгҖӮеҗ„еёӮеҜ№дјҒдёҡеҸ¬еӣһе·ҘдҪңиҰҒејҖеұ•зқЈеҜјжЈҖжҹҘпјҢеҜ№жү§иЎҢеҸ¬еӣһдёҚеҠӣе’ҢеёӮеңәжё…зҗҶдёҚеҪ»еә•зҡ„пјҢдәҲд»ҘдёҘиӮғеӨ„зҗҶгҖӮ
дёүгҖҒвҖңдёӨе»әвҖқе·ҘдҪңйҮҚзӮ№
пјҲдёҖпјүеҠ ејәиҚҜе“Ғз”ҹдә§з»ҸиҗҘ规иҢғе»әи®ҫ
1гҖҒиҝӣдёҖжӯҘеҠ ејәиҚҜе“Ғз”ҹдә§зӣёе…іи§„иҢғе»әи®ҫгҖӮдёҘж је®һж–ҪиҚҜе“ҒGMpпјҢ规иҢғиҚҜе“Ғз”ҹдә§иЎҢдёәгҖӮзқЈдҝғз”ҹдә§дјҒдёҡеҠ еҝ«ж–°дҝ®и®ўиҚҜе“ҒGMpзҡ„е®һж–ҪиҝӣеәҰпјҢиҗҪе®һе…ЁиҝҮзЁӢиҙЁйҮҸз®ЎзҗҶеҲ¶еәҰпјҢиҙЈд»»еҲ°дәәпјҢеұӮеұӮжҠҠе…іпјҢеҒҡеҲ°иҚҜе“ҒеҸҠе…¶еҺҹж–ҷзӯүеҸҜж ёжҹҘгҖҒеҸҜиҝҪжәҜпјҢиҙЁйҮҸиҙЈд»»еҸҜиҗҪе®һгҖӮж №жҚ®еӣҪ家жңү关规е®ҡпјҢеҠ ејәдёӯиҚҜжҸҗеҸ–зӣ‘з®ЎпјҢжҳҺзЎ®дёӯиҚҜжҸҗеҸ–зҡ„з”ҹдә§е’Ңз®ЎзҗҶиҰҒжұӮпјҢйҳІжӯўдёӯиҚҜжҸҗеҮәзү©зҡ„йқһжі•з”ҹдә§е’ҢдҪҝз”ЁгҖӮ规иҢғ委жүҳз”ҹдә§иЎҢдёәпјҢе®Ң善委жүҳз”ҹдә§жҠҖжңҜиҰҒжұӮе’Ңз®ЎзҗҶ规иҢғпјҢејәеҢ–委жүҳз”ҹдә§иҚҜе“Ғзҡ„иҙЁйҮҸз®ЎзҗҶгҖӮдҝ®и®ўе®Ңе–„жҲ‘зңҒиҚҜе“Ғз”ҹдә§ж—Ҙеёёзӣ‘зқЈз®ЎзҗҶеҠһжі•е’ҢиҚҜе“Ғз”ҹдә§и®ёеҸҜиҜҒз®ЎзҗҶеҠһжі•пјҢејәеҢ–иҚҜе“Ғз”ҹдә§ж—Ҙеёёз®ЎзҗҶгҖӮ
2гҖҒиҝӣдёҖжӯҘеҠ ејәиҚҜе“Ғз»ҸиҗҘзӣёе…іи§„иҢғе»әи®ҫгҖӮзқЈдҝғиҚҜе“Ғз»ҸиҗҘдјҒдёҡеҜ№жүҖз»ҸиҗҘиҚҜе“Ғзҡ„иҙЁйҮҸе’Ңиҙӯй”ҖиЎҢдёәиҙҹиҙЈпјҢеҒҡеҲ°дёҘж јиҙӯй”Җз®ЎзҗҶпјҢи®ӨзңҹжҹҘйӘҢдҫӣиҙ§ж–№жҲ–иҙӯиҙ§ж–№зҡ„иө„иҙЁпјҢејҖе…·жҲ–зҙўиҰҒй”Җе”®еҸ‘зҘЁпјҢзЎ®дҝқиҚҜе“Ғжё йҒ“еҸҜжҺ§гҖҒжөҒеҗ‘жё…жҷ°гҖҒзҘЁиҙ§зӣёз¬ҰгҖӮжҠ“еҘҪж–°дҝ®и®ўиҚҜе“ҒGSpзҡ„е®һж–ҪпјҢе®Ңе–„й…ҚеҘ—зҡ„ж ҮеҮҶе’Ң规иҢғпјҢжҸҗй«ҳиҚҜе“ҒжөҒйҖҡзҺҜиҠӮиҙЁйҮҸжҺ§еҲ¶ж°ҙе№ігҖӮдёҘж јдә’иҒ”зҪ‘й”Җе”®иҚҜе“Ғзҡ„и®ёеҸҜпјҢ规иҢғзҪ‘дёҠе”®иҚҜиЎҢдёәгҖӮиҝӣдёҖжӯҘжҸҗй«ҳиҚҜе“Ғз”өеӯҗзӣ‘з®ЎиғҪеҠӣпјҢзЁіжӯҘжҺЁиҝӣе…Ёе“Ғз§ҚгҖҒе…ЁиҝҮзЁӢиҚҜе“Ғз”өеӯҗзӣ‘з®ЎпјҢеҸ‘жҢҘз”өеӯҗзӣ‘з®ЎеңЁиҚҜе“ҒиҝҪжәҜгҖҒжү“еҒҮжҹҘеҠЈгҖҒдҝЎжҒҜз»ҹи®Ўзӯүж–№йқўзҡ„з»јеҗҲж•ҲиғҪгҖӮ
3гҖҒиҝӣдёҖжӯҘеҠ ејәдёӯиҚҜжқҗдё“дёҡеёӮеңә规иҢғе»әи®ҫгҖӮең°ж–№ж”ҝеәңиҰҒйҮҮеҸ–еҲҮе®һжңүж•ҲжҺӘж–ҪпјҢиҗҪе®һејҖеҠһдјҒдёҡдё»дҪ“иҙЈд»»пјҢеҠ ејәдё“дёҡеёӮеңәдәӨжҳ“з®ЎзҗҶпјҢдёҘжҺ§дәӨжҳ“иҢғеӣҙпјҢ规иҢғдәӨжҳ“иЎҢдёәгҖӮеҠ ејәдёӯиҚҜжқҗз§ҚжӨҚз®ЎзҗҶпјҢдҝғиҝӣеҢәеҹҹеҢ–гҖҒ规иҢғеҢ–е’Ң规模еҢ–пјӣеҠ ејәдёӯиҚҜжқҗдә§ең°еҲқеҠ е·Ҙз®ЎзҗҶпјҢ规иҢғеҠ е·ҘиЎҢдёәпјҢж”№иҝӣеҠ е·Ҙе·ҘиүәпјҢйҖҗжӯҘжҸҗй«ҳеҲқеҠ е·Ҙж°ҙе№іпјӣйј“еҠұдёӯиҚҜз”ҹдә§дјҒдёҡеңЁдёӯиҚҜжқҗдё»дә§еҢәе»әз«Ӣз§ҚжӨҚгҖҒз”ҹдә§еҹәең°пјҢдҝқиҜҒдёӯиҚҜжқҗиҙЁйҮҸзЁіе®ҡгҖӮ
пјҲдәҢпјүеҠ ејәиҚҜе“Ғзӣ‘з®ЎжңәеҲ¶е»әи®ҫ
1.е»әз«ӢеҒҘе…ЁзӨҫдјҡзӣ‘зқЈжңәеҲ¶гҖӮиҪ¬еҸҳзӣ‘з®ЎзҗҶеҝөпјҢжӢ“е®Ҫзӣ‘з®ЎжҖқи·ҜпјҢжҸҗеҚҮиҚҜе“Ғзӣ‘з®Ўзҡ„йҖҸжҳҺеәҰпјҢеўһејәе…¬дј—еҸӮдёҺиҚҜе“Ғе®үе…Ёе·ҘдҪңзҡ„з§ҜжһҒжҖ§гҖӮеҠ ејәиҚҜе“Ғзӣ‘з®ЎдҝЎжҒҜе…¬ејҖпјҢеўһеҠ ж¶Ҳиҙ№иҖ…иҺ·еҫ—иҚҜе“ҒиҙЁйҮҸе®үе…ЁдҝЎжҒҜзҡ„йҖ”еҫ„гҖӮе®Ңе–„жҠ•иҜүдёҫжҠҘзі»з»ҹе’ҢдёҫжҠҘеҘ–еҠұеҲ¶еәҰпјҢйј“еҠұзӨҫдјҡзӣ‘зқЈгҖӮеҸ‘жҢҘеӘ’дҪ“зӣ‘зқЈзҡ„з§ҜжһҒдҪңз”ЁпјҢе®Ңе–„ж–°й—»еҸ‘еёғеҲ¶еәҰпјҢеҠ ејәиҚҜе“Ғе®үе…ЁйЈҺйҷ©жІҹйҖҡгҖӮж”ҜжҢҒиЎҢдёҡеҚҸдјҡеҸ‘жҢҘиЎҢдёҡиҮӘеҫӢе’ҢиҮӘжҲ‘зәҰжқҹеҠҹиғҪгҖӮеҠӘеҠӣжһ„е»әиҚҜе“Ғе®үе…ЁзӨҫдјҡе…ұжІ»ж јеұҖгҖӮ
2.е»әз«ӢеҒҘе…ЁдјҒдёҡеҲҶзә§еҲҶзұ»зӣ‘з®ЎжңәеҲ¶гҖӮз»“еҗҲжҲ‘зңҒжӯЈеңЁејҖеұ•зҡ„иҚҜе“Ғе®үе…ЁдҝЎз”ЁдҪ“зі»е»әи®ҫпјҢеҲ¶е®ҡдјҒдёҡеҲҶзә§иҜ„е®ҡж ҮеҮҶпјҢж №жҚ®дјҒдёҡзҠ¶еҶөгҖҒдә§е“ҒжЈҖйӘҢз»“жһңгҖҒж—Ҙеёёзӣ‘зқЈжЈҖжҹҘгҖҒиҝқжі•иҝқ规иЎҢдёәи®°еҪ•зӯүжғ…еҶөпјҢе®һиЎҢеҲҶзә§з®ЎзҗҶгҖӮеҜ№дёҚеҗҢзұ»еҲ«зҡ„дјҒдёҡйҮҮеҸ–жңүй’ҲеҜ№жҖ§зҡ„зӣ‘з®Ўж–№ејҸпјҢејәеҢ–еҜ№йЈҺйҷ©зӯүзә§иҫғй«ҳдјҒдёҡзҡ„зӣ‘зқЈжЈҖжҹҘпјҢеҠ еӨ§еҜ№дҪҺдҝЎиӘүеәҰдјҒдёҡзҡ„зӣ‘зқЈжЈҖжҹҘйў‘ж¬Ўе’Ңдә§е“ҒжЈҖйӘҢжү№ж¬ЎгҖӮ
3.е»әз«ӢеҒҘе…ЁиҚҜе“Ғе®үе…ЁйЈҺйҷ©йҳІжҺ§жңәеҲ¶гҖӮеҗ„ең°иҰҒе»әз«ӢеҒҘе…ЁиҚҜе“Ғе®үе…Ёзӣ‘з®ЎеҪўеҠҝиҜ„дј°еҲҶжһҗдјҡи®®еҲ¶еәҰпјҢе®ҡжңҹиҝӣиЎҢиҚҜе“Ғе®үе…ЁйЈҺйҷ©дјҡе•ҶпјҢжҸҗеүҚеҸ‘зҺ°иҚҜе“Ғе®үе…ЁйЈҺйҷ©дҝЎеҸ·пјҢйҒҝе…ҚйҖ жҲҗе®үе…ЁеҚұе®ігҖӮеҸ‘зҺ°иҫ–еҢәеҶ…дјҒдёҡиҙЁйҮҸз®ЎзҗҶдҪ“зі»еӯҳеңЁзјәйҷ·гҖҒеҸҜиғҪдә§з”ҹйҡҗжӮЈзҡ„пјҢиҰҒеҸҠж—¶зәҰи°ҲдјҒдёҡиҙҹиҙЈдәәпјӣеҸ‘зҺ°дёӢзә§зӣ‘з®ЎйғЁй—ЁеҜ№йЈҺйҷ©дҝЎеҸ·йҮҚи§ҶдёҚеӨҹжҲ–йҮҮеҸ–жҺӘж–ҪдёҚеҠӣзҡ„пјҢиҰҒеҸҠж—¶зәҰи°ҲдёӢзә§зӣ‘з®ЎйғЁй—ЁиҙҹиҙЈдәәпјӣеҜ№еӯҳеңЁеҢәеҹҹжҖ§йЈҺйҷ©пјҢдё”ж¶үеҸҠй—®йўҳеӨҚжқӮзҡ„пјҢиҰҒеҸҠж—¶зәҰи°Ҳең°ж–№ж”ҝеәңиҙҹиҙЈдәәгҖӮжҺЁиЎҢе…¬ејҖзәҰи°ҲпјҢдё»еҠЁжҺҘеҸ—зӨҫдјҡзӣ‘зқЈе’ҢиҲҶи®әзӣ‘зқЈгҖӮ
еӣӣгҖҒвҖңдёӨжү“дёӨе»әвҖқе·ҘдҪңе®үжҺ’
вҖңдёӨжү“дёӨе»әвҖқдё“йЎ№иЎҢеҠЁдёәжңҹеҚҠе№ҙпјҢдё»иҰҒе®үжҺ’еҰӮдёӢпјҡ
пјҲдёҖпјүеҠЁе‘ҳйғЁзҪІпјҲ7жңҲдёӯдёӢж—¬пјүгҖӮеҗ„еёӮгҖҒеҺҝеұҖиҰҒз«ӢеҚіеҸ¬ејҖйғЁзҪІеҠЁе‘ҳдјҡи®®пјҢж·ұе…ҘиҙҜеҪ»еӣҪ家жҖ»еұҖе’ҢзңҒеұҖдјҡи®®зІҫзҘһе’Ңж–№жЎҲиҰҒжұӮпјҢз»јеҗҲиҖғиҷ‘иҫ–еҢәеҶ…иҚҜе“Ғйӣ¶е”®дјҒдёҡзӣ‘з®Ўе®һйҷ…пјҢеҲ¶е®ҡвҖңдёӨжү“дёӨе»әвҖқе·ҘдҪңж–№жЎҲпјҢзЎ®е®ҡе·ҘдҪңйҮҚзӮ№е’Ңд»»еҠЎеҲҶе·ҘпјҢз»ҶеҢ–е·ҘдҪңе®үжҺ’гҖӮеҗ„ең°иҰҒдё»еҠЁеҚҸи°ғеҚ«з”ҹиЎҢж”ҝз®ЎзҗҶйғЁй—ЁпјҢиҝ…йҖҹж‘ёжё…иҫ–еҢәеҶ…иҜҠжүҖжғ…еҶөпјҢд»ҘдҫҝеҲ¶е®ҡеҲҮе®һеҸҜиЎҢзҡ„ж–№жЎҲгҖӮдәіе·һеёӮеұҖиҰҒдё»еҠЁеҗ‘еёӮж”ҝеәңжұҮжҠҘпјҢеҒҡеҘҪдёӯиҚҜжқҗеёӮеңәж•ҙжІ»жңүе…іж–№йқўзҡ„иЎ”жҺҘе·ҘдҪңгҖӮ
пјҲдәҢпјүиҮӘжҹҘиҮӘзә (7жңҲдёӢж—¬иҮі8жңҲдёҠж—¬)гҖӮе…ЁзңҒжүҖжңүиҚҜе“Ғз”ҹдә§гҖҒз»ҸиҗҘдјҒдёҡеқҮиҰҒеҜ№з…§дёҠиҝ°е·ҘдҪңйҮҚзӮ№и®ӨзңҹејҖеұ•иҮӘжҹҘиҮӘзә гҖӮеҗ„еёӮгҖҒеҺҝеұҖиҰҒеҸ¬ејҖиҫ–еҢәеҶ…жүҖжңүиҚҜе“Ғз”ҹдә§гҖҒз»ҸиҗҘдјҒдёҡиҙҹиҙЈдәәдјҡи®®пјҢиҝӣиЎҢе®Јдј еҠЁе‘ҳгҖӮиҰҒеҠ ејәеҲҶзұ»жҢҮеҜјпјҢзқЈдҝғдјҒдёҡдё»еҠЁжҹҘжүҫгҖҒж•ҙж”№еӯҳеңЁзҡ„й—®йўҳпјҢејәеҢ–дјҒдёҡиҜҡдҝЎиҮӘеҫӢпјҢеҲҮе®һеҒҡеҲ°е®Јдј еҸ‘еҠЁеҲ°дҪҚгҖҒи®ӨиҜҶжҸҗй«ҳеҲ°дҪҚгҖҒй—®йўҳжҹҘжүҫеҲ°дҪҚгҖҒж•ҙж”№иҗҪе®һеҲ°дҪҚгҖҒиҙЈд»»иҗҪе®һеҲ°дҪҚгҖӮеҗ„иҚҜе“Ғз”ҹдә§гҖҒз»ҸиҗҘдјҒдёҡзҡ„иҮӘжҹҘиҮӘзә жҠҘе‘Ҡеә”дәҺ8жңҲдёҠж—¬еүҚжҠҘйҖҒжүҖеңЁең°зҡ„еёӮгҖҒеҺҝеұҖгҖӮдәіе·һдёӯиҚҜжқҗеёӮеңәејҖеҠһдё»дҪ“иҰҒжҢүиҰҒжұӮиҝӣиЎҢиҮӘжҹҘиҮӘзә гҖӮ
пјҲдёүпјүе…ЁйқўжЈҖжҹҘпјҲ7жңҲдёӢж—¬иҮі11жңҲпјүгҖӮд»Һ7жңҲдёӢж—¬иө·пјҢејҖе§ӢеҗҜеҠЁиҚҜе“Ғз”ҹдә§гҖҒз»ҸиҗҘдјҒдёҡзҡ„зҺ°еңәжЈҖжҹҘе·ҘдҪңгҖӮзңҒеұҖиҙҹиҙЈе…ЁзңҒиҚҜе“Ғз”ҹдә§дјҒдёҡжЈҖжҹҘзҡ„з»„з»Үе’ҢзқЈжҹҘпјҢеҗ„еёӮеұҖиҙҹиҙЈеҜ№иҫ–еҢәеҶ…иҚҜе“Ғз”ҹдә§иҝӣиЎҢе…ЁйқўжЈҖжҹҘпјӣеёӮеұҖдё»иҰҒиҙҹиҙЈз»„з»ҮеҜ№иҫ–еҢәеҶ…иҚҜе“Ғз»ҸиҗҘдјҒдёҡзҡ„зӣ‘зқЈжЈҖжҹҘпјӣиҜҠжүҖжҢүиҫ–еҢәз®ЎзҗҶеҺҹеҲҷпјҢз”ұзӣёеә”еёӮеҺҝеұҖз»„з»ҮжЈҖжҹҘпјӣдәіе·һеёӮж”ҝеәңиҙҹиҙЈз»„з»ҮеҜ№дёӯиҚҜжқҗдё“дёҡеёӮеңәзҡ„ж•ҙжІ»гҖӮеңЁеёӮеұҖжЈҖжҹҘзҡ„еҗҢж—¶пјҢзңҒеұҖе°Ҷз»„з»ҮеҜ№йҮҚзӮ№ең°еҢәзҡ„зқЈжҹҘе’ҢеҜ№йҮҚзӮ№дјҒдёҡзҡ„йЈһиЎҢжЈҖжҹҘгҖӮ
пјҲеӣӣпјүдё“йЎ№жҠҪйӘҢпјҲ8жңҲиҮі11жңҲпјүгҖӮ7жңҲеә•еүҚе®ҢжҲҗжҠҪйӘҢе·ҘдҪңйғЁзҪІпјҢ8жңҲејҖе§ӢиҚҜе“ҒжҠҪйӘҢпјҢ8жңҲеә•еүҚеҸ–еҫ—йҳ¶ж®өжҖ§жЈҖйӘҢз»“жһңгҖӮзңҒеұҖиҙҹиҙЈе…ЁзңҒиҚҜе“Ғдё“йЎ№жҠҪйӘҢзҡ„жҢҮеҜје’Ңе®үжҺ’пјҢеҗ„еёӮеұҖз»“еҗҲжң¬ең°е®һйҷ…пјҢеҲ¶е®ҡдё“йЎ№жҠҪйӘҢи®ЎеҲ’пјҢй’ҲеҜ№еҸҜиғҪеӯҳеңЁй—®йўҳзҡ„е“Ғз§ҚпјҢжҠ“зҙ§ејҖеұ•иҚҜе“Ғдё“йЎ№жҠҪйӘҢе·ҘдҪңгҖӮиҚҜе“Ғдё“йЎ№жҠҪйӘҢеә”з»“еҗҲзӣ‘зқЈжЈҖжҹҘдёҖ并ејҖеұ•гҖӮ
пјҲдә”пјүз«ӢжЎҲжҹҘеӨ„пјҲ7жңҲиҮі12жңҲпјүгҖӮеҜ№зӣ‘зқЈжЈҖжҹҘе’Ңдё“йЎ№жҠҪйӘҢеҸ‘зҺ°зҡ„жЎҲ件зәҝзҙўжҹҘе®һеұһиҝқжі•иҝқ规иЎҢдёәзҡ„пјҢеҗ„ең°иҰҒеҸҠж—¶дәҲд»Ҙз«ӢжЎҲпјҢдҫқжі•ејҖеұ•жҹҘеӨ„гҖӮ
пјҲе…ӯпјүе…ЁйқўжҖ»з»“пјҲ2016е№ҙ12жңҲпјүгҖӮдё“йЎ№иЎҢеҠЁз»“жқҹеҗҺпјҢеҗ„еёӮеұҖпјҲзңҒзӣҙз®ЎеҺҝеұҖпјүеҜ№иҫ–еҢәеҶ…иҚҜе“Ғз”ҹдә§гҖҒиҚҜе“Ғз»ҸиҗҘгҖҒдёӯиҚҜжқҗдё“дёҡеёӮеңәж•ҙжІ»вҖңдёӨжү“дёӨе»әвҖқжғ…еҶөиҝӣиЎҢи®ӨзңҹжҖ»з»“пјҢ并дәҺ12жңҲ20ж—ҘеүҚеҪўжҲҗжҠҘе‘ҠжҠҘзңҒеұҖгҖӮ
дә”гҖҒвҖңдёӨжү“дёӨе»әвҖқе·ҘдҪңиҰҒжұӮ
пјҲдёҖпјүеҠ ејәз»„з»ҮйўҶеҜјгҖӮеҗ„еёӮеҺҝеұҖиҰҒй«ҳеәҰйҮҚи§ҶпјҢеҲҮе®һеҠ ејәз»„з»ҮйўҶеҜјпјҢжҠҠвҖңдёӨжү“дёӨе»әвҖқиЎҢеҠЁдҪңдёәеҪ“еүҚйҮҚиҰҒд»»еҠЎпјҢжҳҺзЎ®е·ҘдҪңжңәжһ„е’Ңд»»еҠЎеҲҶе·ҘпјҢзІҫеҝғз»„з»ҮпјҢе‘ЁеҜҶйғЁзҪІпјҢжҺЁиҝӣеҗ„йЎ№е·ҘдҪңйЎәеҲ©ејҖеұ•гҖӮеҪ“еүҚжӯЈеҖјйЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎдҪ“еҲ¶ж”№йқ©е’Ңжңәжһ„и°ғж•ҙж—¶жңҹпјҢеҗ„ең°иҰҒеҒҡеҲ°жңәжһ„ж”№йқ©е’Ңж•ҙжІ»иЎҢеҠЁдёӨжүӢжҠ“гҖҒдёӨдёҚиҜҜгҖҒдёӨдҝғиҝӣпјҢзЎ®дҝқж”ҝд»Өз•…йҖҡгҖҒиҝҗиҪ¬йЎәз•…гҖҒеҸ–еҫ—е®һж•ҲгҖӮ
пјҲдәҢпјүдҫқжі•еұҘиЎҢиҒҢиҙЈгҖӮеҗ„зә§йЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎйғЁй—ЁеңЁзӣ‘зқЈжү§жі•дёӯиҰҒеҒҡеҲ°е…¬ејҖгҖҒе…¬е№ігҖҒе…¬жӯЈпјҢдёҚд»ҺдәӢеҸҜиғҪеҪұе“Қе…¬жӯЈжү§жі•зҡ„жӢӣе•Ҷеј•иө„жҙ»еҠЁпјҢдёҚеҸ—ж— е…іеӣ зҙ зҡ„е№Іжү°гҖӮеқҡеҶійҳІжӯўең°ж–№дҝқжҠӨпјҢеҜ№зӣ‘зқЈжЈҖжҹҘдёӯеҸ‘зҺ°зҡ„жЎҲжәҗпјҢиҰҒеҸҠж—¶й”Ғе®ҡиҜҒжҚ®пјҢдёҘеӯ—еҪ“еӨҙпјҢж·ұжҹҘж·ұ究пјҢеӨ„зҗҶеҲ°дҪҚпјҢеқҡеҶіжқңз»қжңүжЎҲдёҚжҹҘгҖҒйҮҚжЎҲиҪ»еҠһгҖҒд»ҘзҪҡд»Јз®ЎгҖҒд»ҘзҪҡд»ЈеҲ‘гҖӮзӣ‘з®Ўдәәе‘ҳиҰҒиҮӘи§үйҒөе®Ҳзӣ‘зқЈжү§жі•е’Ңе»үж”ҝе·ҘдҪңзәӘеҫӢпјҢдёҚеҫ—еҸӮеҠ еҸҜиғҪеҪұе“Қе…¬жӯЈжү§жі•зҡ„жҙ»еҠЁпјҢдёҚеҫ—жҺҘеҸ—дјҒдёҡеҗғиҜ·е’ҢзӨјйҮ‘зӯүгҖӮ
пјҲдёүпјүејәеҢ–йғЁй—ЁиҒ”еҠЁгҖӮеҗ„зә§йЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎйғЁй—ЁиҰҒеҠ ејәйғЁй—ЁиҒ”еҠЁпјҢеҜҶеҲҮдёҺжңүе…ійғЁй—Ёзҡ„еҚҸеҗҢй…ҚеҗҲпјҢдәүеҸ–ж”ҜжҢҒпјҢеҪўжҲҗжү“еҮ»ж•ҙжІ»зҡ„еҗҲеҠӣгҖӮеҜ№ж¶үе«Ңи§ҰзҠҜеҲ‘еҫӢзҡ„пјҢ移дәӨе…¬е®үжңәе…іеӨ„зҗҶпјӣеҜ№иҝқжі•д»ҺдәӢдә’иҒ”зҪ‘иҚҜе“ҒдәӨжҳ“жңҚеҠЎзҡ„пјҢ移дәӨдә’иҒ”зҪ‘з®ЎзҗҶйғЁй—ЁеӨ„зҗҶпјӣеҜ№еӯҳеңЁиҝқжі•иҙӯй”ҖиҚҜе“ҒиЎҢдёәзҡ„иҜҠжүҖпјҢдҫқжі•еӨ„зҗҶеҗҺ移дәӨеҚ«з”ҹиЎҢж”ҝз®ЎзҗҶйғЁй—ЁгҖӮ
пјҲеӣӣпјүеҒҡеҘҪе®Јдј е’ҢдҝЎжҒҜжҠҘйҖҒгҖӮеҗ„еёӮиҰҒжҢүз…§ж–°й—»е®Јдј зҡ„иҰҒжұӮпјҢ规иҢғдҝЎжҒҜеҸ‘еёғгҖӮж¶үеҸҠжЎҲ件жҹҘеӨ„жғ…еҶөзҡ„дҝЎжҒҜпјҢз”ұзңҒеұҖз»ҹдёҖз»„з»ҮеҸ‘еёғгҖӮж¶үеҸҠйҮҚеӨ§жЎҲ件зҡ„е°Ҷз”ұеӣҪ家жҖ»еұҖз»ҹдёҖеҸ‘еёғгҖӮеҗ„еёӮеұҖиҰҒеңЁжҜҸжңҲ25ж—ҘеүҚе°Ҷдё“йЎ№иЎҢеҠЁиҝӣеұ•жғ…еҶөеҸҠзӣёе…іиЎЁж јжҠҘйҖҒиҮізңҒеұҖеҠһе…¬е®ӨгҖӮ
пјҲдә”пјүеҠ ејәзқЈеҜјжЈҖжҹҘгҖӮзңҒеұҖе°ҶдёҚе®ҡжңҹеҜ№еҗ„еёӮвҖңдёӨжү“дёӨе»әвҖқе·ҘдҪңиҝӣиЎҢжЈҖжҹҘпјҢеҜ№е·ҘдҪңжүҺе®һпјҢдё»еҠЁз ҙиҺ·йҮҚеӨ§жЎҲ件зҡ„еҚ•дҪҚе’ҢдёӘдәәпјҢе°Ҷз»ҷдәҲиЎЁжү¬е’ҢеҘ–еҠұгҖӮеҜ№зӣ‘з®ЎдёҚеҲ°дҪҚгҖҒиҙЈд»»дёҚиҗҪе®һжҲ–йҮҚеӨ§жЎҲ件еӨ„зҗҶдёҚеҸҠж—¶зҡ„пјҢе°ҶиҙЈд»Өж”№жӯЈпјҢ并еҗ‘ең°ж–№ж”ҝеәңйҖҡжҠҘпјӣжғ…иҠӮдёҘйҮҚзҡ„пјҢе°Ҷеҗ‘зӣ‘еҜҹжңәе…іжҸҗеҮәиЎҢж”ҝзӣ‘еҜҹе»әи®®пјӣеӯҳеңЁзҺ©еҝҪиҒҢе®ҲгҖҒеӨұиҒҢжёҺиҒҢгҖҒж»Ҙз”ЁиҒҢжқғгҖҒеҫҮз§ҒиҲһејҠиЎҢдёәзҡ„пјҢе°Ҷдҫқжі•дҫқзәӘеҜ№зӣёе…ідәәе‘ҳиҝҪ究иҙЈд»»гҖӮ
зҜҮеӣӣ:дёүжҳҜзӘҒеҮәйҮҚзӮ№,иҰҶзӣ–е…ЁйқўгҖӮз»“еҗҲе…·дҪ“еҢ»з–—еҷЁжў°жҠҪжЈҖе“Ғз§Қе’ҢжҲ‘иҫ–еҢәе®һйҷ…жғ…еҶө,гҖӮ
2016е№ҙиҚҜе“ҒеёӮеңәзӣ‘з®Ўе·ҘдҪңи®ЎеҲ’6зҜҮ
第1зҜҮ
дёҖгҖҒи®ӨзңҹжҠ“еҘҪиҚҜе“Ғе®үе…Ёдё“йЎ№ж•ҙжІ»е·ҘдҪң
дёҖжҳҜз»„з»ҮејҖеұ•з–«иӢ—иҙЁйҮҸдё“йЎ№жЈҖжҹҘгҖӮйҮҚзӮ№жЈҖжҹҘзӢӮзҠ¬з—…з–«иӢ—гҖҒз”ІеһӢH1N1жөҒж„ҹз–«иӢ—гҖҒйә»з–№з–«иӢ—зӯүйў„йҳІжҖ§з”ҹзү©еҲ¶е“Ғзҡ„иҝӣиҙ§жё йҒ“гҖҒеҶ·й“ҫиҝҗиҫ“гҖҒеӮЁеӯҳжқЎд»¶пјҢдҝқйҡңе…¬дј—з–«иӢ—жҺҘз§Қе®үе…ЁгҖӮдәҢжҳҜејҖеұ•иҝқжі•е№ҝе‘Ҡдё“йЎ№ж•ҙжІ»иЎҢеҠЁгҖӮз§ҜжһҒй…ҚеҗҲе·Ҙе•ҶйғЁй—ЁпјҢеӨ§еҠӣж•ҙжІ»иҷҡеҒҮиҝқжі•иҚҜе“Ғе№ҝе‘ҠгҖӮеҜ№иҝқжі•жғ…иҠӮдёҘйҮҚзҡ„е№ҝе‘ҠиҚҜе“ҒпјҢеқҡеҶійҮҮеҸ–иЎҢж”ҝејәеҲ¶жҺӘж–ҪпјҢжҡӮеҒңе…¶еңЁиҫ–еҢәеҶ…зҡ„й”Җе”®гҖӮдёүжҳҜз»„з»ҮејҖеұ•дёӯиҚҜжқҗгҖҒдёӯиҚҜйҘ®зүҮиҙЁйҮҸдё“йЎ№жЈҖжҹҘгҖӮйҮҚзӮ№жЈҖжҹҘдёӯиҚҜжқҗгҖҒдёӯиҚҜйҘ®зүҮиҙЁйҮҸеҸҠиҙӯй”Җжё йҒ“еҗҲжі•жҖ§пјҢдёҘеҺүжү“еҮ»жҺәжқӮдҪҝеҒҮгҖҒд»Ҙж¬Ўе……еҘҪзҡ„иЎҢдёәгҖӮ
дҪңдёәз»„з»ҮеҚҸи°ғж–№йқўзҡ„е·ҘдҪңпјҢиҰҒжҢүз…§зңҒеұҖзҡ„йғЁзҪІиҰҒжұӮпјҢе…Ёйқўз»„з»ҮеҚҸи°ғеҘҪеӣӣдёӘйҳ¶ж®өзҡ„е·ҘдҪңпјҡ
3жңҲвҖ•4жңҲ30ж—ҘдёәдјҒдёҡиҮӘжҹҘж•ҙж”№йҳ¶ж®өгҖӮйҖҡиҝҮе®Јдј еҸ‘еҠЁпјҢз»„з»ҮдјҒдёҡи®ӨзңҹејҖеұ•иҮӘжҹҘпјҢж•ҙж”№з»“жқҹеҗҺпјҢеЎ«еҶҷгҖҠиҚҜе“Ғе®үе…Ёдё“йЎ№ж•ҙжІ»иҮӘжҹҘж•ҙж”№жғ…еҶөиЎЁгҖӢпјҢ并еҶҷеҮәиҮӘжҹҘж•ҙж”№жҠҘе‘ҠгҖӮеёӮеңә科иҙҹиҙЈжү№еҸ‘еҸҠйӣ¶е”®иҝһй”ҒдјҒдёҡзҡ„иҮӘжҹҘж•ҙж”№пјҢе…¶дҪҷе®һиЎҢиҫ–еҢәиҙҹиҙЈеҲ¶гҖӮ
5жңҲ1ж—ҘвҖ•9жңҲ30ж—Ҙдёәе…ЁйқўжЈҖжҹҘйӣҶдёӯж•ҙжІ»йҳ¶ж®өгҖӮиҰҒејҖеұ•е…Ёйқўзҡ„зӣ‘зқЈжЈҖжҹҘпјҢйӣҶдёӯеҠӣйҮҸжҹҘеӨ„дё“йЎ№ж•ҙжІ»жҙ»еҠЁдёӯеҸ‘зҺ°зҡ„еӨ§жЎҲиҰҒжЎҲпјҢеҲҮе®һи§ЈеҶідё“йЎ№ж•ҙжІ»дёӯжҹҘеҮәзҡ„йҮҚеӨ§й—®йўҳгҖӮ
7жңҲ1ж—ҘвҖ•10жңҲ31ж—ҘдёәзқЈеҜјжЈҖжҹҘйҳ¶ж®өгҖӮиҰҒеңЁйҖӮе®ңзҡ„ж—¶й—ҙпјҢз»„з»Үдәәе‘ҳеҜ№еҗ„еёӮеҢәзҡ„дё“йЎ№ж•ҙжІ»жҙ»еҠЁејҖеұ•жғ…еҶөиҝӣиЎҢзқЈеҜјжЈҖжҹҘпјҢдҝғдҪҝеҗ„еёӮеҢәиҗҪе®һж•ҙж”№жҺӘж–ҪпјҢе®һзҺ°ж•ҙжІ»зӣ®ж ҮгҖӮеҗҢж—¶пјҢиҰҒеҒҡеҘҪиҝҺжҺҘзңҒеұҖз»„з»Үзҡ„зқЈеҜјжЈҖжҹҘзҡ„еҗ„йЎ№еҮҶеӨҮгҖӮ
11жңҲ1ж—ҘвҖ•12жңҲ31ж—ҘдёәжҖ»з»“жҸҗй«ҳйҳ¶ж®өгҖӮиҰҒеңЁж•ҙж”№е®Ңе–„зҡ„еҹәзЎҖдёҠпјҢе»әз«Ӣй•ҝж•ҲжңәеҲ¶пјҢж¶ҲйҷӨе®үе…ЁйҡҗжӮЈпјҢжҸҗеҚҮиҚҜе“Ғе®үе…Ёдҝқйҡңж°ҙе№ігҖӮ
дәҢгҖҒеҠ ејәеҹәжң¬иҚҜзү©зӣ‘зқЈз®ЎзҗҶ
дёҖжҳҜиҰҒејәеҢ–еҹәжң¬иҚҜзү©з»ҸиҗҘй…ҚйҖҒзҡ„зӣ‘з®ЎпјҢдёҘж јй…ҚйҖҒдјҒдёҡзҡ„иө„ж је®ЎжҹҘпјҢе»әз«Ӣй…ҚйҖҒдјҒдёҡзӣ‘з®ЎжЎЈжЎҲпјҢеҠ ејәеҜ№еҹәжң¬иҚҜзү©й…ҚйҖҒдјҒдёҡзҡ„еӮЁеӯҳгҖҒиҝҗиҫ“жқЎд»¶зҡ„зӣ‘зқЈжЈҖжҹҘгҖӮиҰҒзү№еҲ«е…іжіЁиҝҮжёЎжңҹ(3вҖ•9жңҲд»Ҫ)еҹәжң¬иҚҜзү©й…ҚйҖҒжғ…еҶөпјҢжңүй’ҲеҜ№жҖ§ең°йҮҮеҸ–зӣ‘з®ЎжҺӘж–ҪпјҢдҝқиҜҒеҹәжң¬иҚҜзү©еҸҠж—¶гҖҒи¶ійҮҸгҖҒдҝқиҙЁдҫӣеә”гҖӮдәҢжҳҜжҢүз…§зңҒеұҖзҡ„з»ҹдёҖе®үжҺ’пјҢз§ҜжһҒжҺЁиҝӣжү№еҸ‘дјҒдёҡгҖҒйӣ¶е”®иҝһй”ҒдјҒдёҡзҪ‘дёҠзӣ‘жҺ§пјҢе®Ңе–„иҚҜе“Ғе®үе…ЁиҝҪжәҜжүӢж®өпјҢиҝӣдёҖжӯҘејәеҢ–еҹәжң¬иҚҜзү©иҙЁйҮҸдҝқиҙЁдҪ“зі»гҖӮ
еҜ№иҝҷйЎ№е·ҘдҪңжҖ»зҡ„иҰҒжұӮжҳҜпјҡд»ҺзҺ°еңЁиө·пјҢеёӮеҺҝдёӨзә§иҚҜзӣ‘йғЁй—ЁпјҢйғҪиҰҒз§ҜжһҒиЎҢеҠЁпјҢдёҚж–ӯжҺўзҙўпјҢи®ӨзңҹжҖ»з»“иҝҷж–№йқўзҡ„зӣ‘з®Ўз»ҸйӘҢпјҢжӢҹе®ҡдәҺ第еӣӣеӯЈеәҰпјҢеҸ¬ејҖдёҖж¬Ўеҹәжң¬иҚҜзү©зӣ‘з®Ўз ”и®ЁдјҡпјҢд»ҘиҫҫеҲ°дәӨжөҒз»ҸйӘҢгҖҒе…ұеҗҢжҸҗй«ҳзҡ„зӣ®зҡ„гҖӮ
дёүгҖҒеҠ ејәиҚҜе“Ғз»ҸиҗҘи®ёеҸҜиҜҒжҚўиҜҒе’ҢGSpи®ӨиҜҒе·ҘдҪң
дёҖжҳҜеҲ°д»Ҡе№ҙе№ҙеә•пјҢе…ЁеёӮеә”жҚўиҜҒзҡ„иҚҜе“Ғйӣ¶е”®дјҒдёҡжҖ»е…ұдёә210家пјҢиҰҒд»ҺдёҘжҺҢжҸЎжҚўиҜҒж ҮеҮҶпјҢдҝқиҜҒеҒҡеҲ°е…¬е№ігҖҒе…¬жӯЈгҖҒе…¬ејҖгҖӮд»Һз»Ҷе®үжҺ’е·ҘдҪңиҝӣеәҰпјҢи®ӨзңҹеҒҡеҘҪд»Ҡе№ҙзҡ„жҚўиҜҒе·ҘдҪңгҖӮеёӮеұҖе°ҶжҠҠжҜҸ家иҚҜеә—зҡ„жңүж•Ҳжңҹзҡ„е…·дҪ“еҲ°жңҹж—¶й—ҙпјҢйҖҗжңҲз»ҶеҢ–пјҢйҖҡзҹҘеҗ„еёӮеҢәеұҖпјҢд»Ҙдҫҝеҗ„еёӮеҢәеұҖеҸҠж—¶зқЈеҜјпјҢдҝғдҪҝеҗ„иҚҜеә—йҖӮж—¶жҚўиҜҒгҖӮдәҢжҳҜд»Ҡе№ҙе…ЁеёӮзҡ„иҚҜе“Ғйӣ¶е”®дјҒдёҡпјҢж–°ејҖеҠһзҡ„иҚҜеә—е’ҢGSpи®ӨиҜҒеҲ°жңҹеҗҺеә”йҮҚж–°и®ӨиҜҒзҡ„иҚҜеә—е…ұжңү497家гҖӮжҲ‘们иҰҒжҖ»з»“2016е№ҙи®ӨиҜҒе·ҘдҪңзҡ„з»ҸйӘҢпјҢжҢүз…§з»ҸиҗҘи®ёеҸҜиҜҒжҚўиҜҒзҡ„еҺҹеҲҷе’Ңж–№жі•пјҢд»ҺдёҘд»Һз»ҶпјҢе…ЁйқўеҒҡеҘҪи®ӨиҜҒе·ҘдҪңгҖӮ
иҝҷдёӨйЎ№е·ҘдҪңпјҢд»Һе№ҙеҲқиө·е·Із»ҸејҖе§ӢиҝӣиЎҢпјҢе…Ёе№ҙйңҖиҰҒйҡҸеҲ°жңҹйҡҸе®үжҺ’еҠһзҗҶпјҢеҲ°12жңҲдёҠж—¬е…Ёйқўе®ҢжҲҗгҖӮ
еӣӣгҖҒе…ЁйқўжҺЁиҝӣиҚҜе“ҒиҙЁйҮҸ规иҢғеҢ–з®ЎзҗҶе·ҘдҪң
жҲ‘еёӮгҖҠиҚҜе“ҒдҪҝз”ЁиҙЁйҮҸз®ЎзҗҶ规иҢғгҖӢзҡ„е®һж–Ҫе·ҘдҪңпјҢжҢүз…§ж•ҙдҪ“е·ҘдҪң规еҲ’пјҢд»Ҡе№ҙеҝ…йЎ»е®ҢжҲҗзәҰ700家еҢ»з–—жңәжһ„зҡ„зҺ°еңәжЈҖжҹҘе’ҢзЎ®и®Өе·ҘдҪңд»»еҠЎгҖӮ
иҝҷйЎ№е·ҘдҪңзҡ„е…·дҪ“е®үжҺ’жҳҜпјҡеёӮеұҖеҸҠеұҖдәҺ5жңҲд»Ҫе®ҢжҲҗеҹ№и®ӯе·ҘдҪңпјҢ9жңҲд»Ҫе®ҢжҲҗзҺ°еңәжЈҖжҹҘзЎ®и®Өе·ҘдҪңгҖӮ第еӣӣеӯЈеәҰиҝӣиЎҢе…ЁйқўиЎҘжјҸе’Ңж•ҙж”№пјҢ12жңҲ15ж—ҘеүҚе®ҢжҲҗе…ЁеёӮзҡ„зЎ®и®Өе·ҘдҪңжҖ»з»“гҖӮ
第2зҜҮдёҖгҖҒж·ұе…ҘејҖеұ•еҢ»з–—еҷЁжў°дё“йЎ№ж•ҙжІ»е·ҘдҪң
дёәжүҺе®һжҺЁиҝӣй«ҳйЈҺйҷ©еҢ»з–—еҷЁжў°дё“йЎ№ж•ҙжІ»е·ҘдҪңпјҢ规иҢғеёӮеңә秩еәҸпјҢж №жҚ®зңҒеұҖгҖҠе…ідәҺејҖеұ•йӘЁз§‘жӨҚе…ҘеҷЁжў°з»ҸиҗҘдё“йЎ№жЈҖжҹҘзҡ„йҖҡзҹҘгҖӢиҰҒжұӮпјҢд»Ҡе№ҙе°ҶеҜ№йӘЁз§‘жӨҚе…ҘеҷЁжў°зҡ„з»ҸиҗҘдҪҝз”ЁиҝӣиЎҢдё“йЎ№ж•ҙжІ»пјҢе…Ёйқўжё…зҗҶиҝқжі•з»ҸиҗҘдҪҝз”ЁйӘЁз§‘жӨҚе…ҘеҷЁжў°зҡ„иЎҢдёәгҖӮ
жЈҖжҹҘеҶ…е®№дё»иҰҒеҢ…жӢ¬пјҡ
1гҖҒз»ҸиҗҘеҚ•дҪҚпјҡжЈҖжҹҘдјҒдёҡжҳҜеҗҰе…·жңүз»ҸиҗҘйӘЁз§‘жӨҚе…ҘеҷЁжў°иө„иҙЁпјӣжҳҜеҗҰжҢӮйқ з»ҸиҗҘгҖҒиө°зҘЁгҖҒи¶…иҢғеӣҙз»ҸиҗҘйӘЁз§‘жӨҚе…ҘеҷЁжў°пјӣиҝӣиҙ§жё йҒ“жҳҜеҗҰеҗҲжі•пјӣдә§е“Ғз”ҹдә§и®ёеҸҜиҜҒгҖҒжіЁеҶҢиҜҒгҖҒеҗҲж јиҜҒд»ҘеҸҠжЈҖжөӢжҠҘе‘ҠжҳҜеҗҰйҪҗе…Ёжңүж•Ҳпјӣиҝӣиҙ§йӘҢ收记еҪ•е’Ңй”Җе”®и®°еҪ•жҳҜеҗҰйҪҗ全规иҢғ并дҝқеӯҳпјӣз»ҸиҗҘеңәжүҖе’Ңд»“еә“и®ҫеӨҮи®ҫж–ҪжҳҜеҗҰйҪҗ全并з¬ҰеҗҲиҰҒжұӮпјӣиҙЁйҮҸз®ЎзҗҶдәәе‘ҳжҳҜеҗҰеңЁиҒҢеңЁеІ—пјӣз»ҸиҗҘеңәжүҖе’Ңд»“еә“ең°еқҖжҳҜеҗҰе’Ңи®ёеҸҜиҜҒдёҖиҮҙпјӣи®Ўз®—жңәз®ЎзҗҶзі»з»ҹжҳҜеҗҰжӯЈеёёиҝҗиЎҢпјӣдә§е“ҒжҳҜеҗҰеҸҜд»ҘиҝҪжәҜзӯүгҖӮ
2гҖҒдҪҝз”ЁеҚ•дҪҚпјҡжЈҖжҹҘиҝӣиҙ§жё йҒ“жҳҜеҗҰеҗҲжі•пјӣдә§е“Ғз”ҹдә§и®ёеҸҜиҜҒгҖҒжіЁеҶҢиҜҒгҖҒеҗҲж јиҜҒд»ҘеҸҠжЈҖжөӢжҠҘе‘ҠжҳҜеҗҰйҪҗе…Ёжңүж•Ҳпјӣиҝӣиҙ§йӘҢ收记еҪ•жҳҜеҗҰйҪҗ全规иҢғ并дҝқеӯҳпјӣдә§е“ҒжҳҜеҗҰеҸҜд»ҘиҝҪжәҜзӯүгҖӮ
ж—¶й—ҙе®үжҺ’пјҡ
1гҖҒе…ЁйқўжЈҖжҹҘгҖҒйӣҶдёӯж•ҙжІ»пјҲ2016е№ҙ4жңҲ6ж—ҘпјҚ8жңҲ30ж—Ҙпјү
еҜ№йӘЁз§‘жӨҚе…ҘеҷЁжў°з»ҸиҗҘдјҒдёҡе’ҢдҪҝз”ЁеҚ•дҪҚиҝӣиЎҢе…ЁйқўжЈҖжҹҘгҖӮеҜ№жЈҖжҹҘдёӯеҸ‘зҺ°зҡ„й—®йўҳпјҢйҖҗдёҖжҸҗеҮәж•ҙж”№ж„Ҹи§ҒпјҢзқЈдҝғйҷҗжңҹж•ҙж”№гҖӮеҜ№иҝқжі•иҝқ规иЎҢдёәпјҢдҫқжі•дёҘеҺүжҹҘеӨ„гҖӮ
2гҖҒжҖ»з»“жҸҗй«ҳйҳ¶ж®өпјҲ2016е№ҙ9жңҲ1ж—Ҙ�9жңҲ30ж—Ҙпјү
еҜ№дё“йЎ№жЈҖжҹҘиҝӣиЎҢе…ЁйқўжҖ»з»“гҖӮеҜ№жЈҖжҹҘдёӯеҸ‘зҺ°зҡ„зӘҒеҮәй—®йўҳпјҢеңЁж•ҙж”№зҡ„еҹәзЎҖдёҠпјҢе®Ңе–„е·ҘдҪңеҲ¶еәҰгҖӮеҜ№е…ёеһӢжЎҲдҫӢиҝӣиЎҢеҲҶжһҗпјҢдёәиҝӣдёҖжӯҘеҒҡеҘҪй«ҳйЈҺйҷ©еҢ»з–—еҷЁжў°зӣ‘з®Ўе·ҘдҪңжҸҗеҮәе»әи®ҫжҖ§ж„Ҹи§ҒгҖӮ
дәҢгҖҒе…ЁеҠӣзЎ®дҝқй«ҳйЈҺйҷ©еҢ»з–—еҷЁжў°иҙЁйҮҸе®үе…Ё
继з»ӯжҠ“еҘҪй«ҳйЈҺйҷ©еҢ»з–—еҷЁжў°дә§е“Ғзҡ„зӣ‘з®ЎпјҢеҠ ејәеҜ№й«ҳйЈҺйҷ©еҢ»з–—еҷЁжў°з”ҹдә§дјҒдёҡиҙЁйҮҸдҪ“зі»зҡ„зӣ‘зқЈжЈҖжҹҘгҖӮз»„з»ҮеҜ№з”ҹдә§дёҖж¬ЎжҖ§дҪҝз”Ёж— иҸҢиҫ“жіЁеҷЁе…·гҖҒйӘЁз§‘жӨҚе…Ҙзү©гҖҒеҠЁзү©жәҗдә§е“ҒгҖҒиЎҖж¶ІйҖҸжһҗжқҗж–ҷгҖҒеҢ»з”ЁзјқеҗҲй’Ҳзӯүй«ҳйЈҺйҷ©еҢ»з–—еҷЁжў°з”ҹдә§дјҒдёҡиҙЁйҮҸдҪ“зі»зҡ„зӣ‘зқЈжЈҖжҹҘгҖӮйҮҚзӮ№жЈҖжҹҘз”ҹдә§дјҒдёҡжү§иЎҢж ҮеҮҶжғ…еҶөпјҢеҺҹжқҗж–ҷйҮҮиҙӯжҺ§еҲ¶е’ҢйӘҢиҜҒжғ…еҶөпјҢе·ҘиүәиҝҮзЁӢжҺ§еҲ¶жғ…еҶөпјҢжЈҖйӘҢе’ҢиҙЁйҮҸжҺ§еҲ¶жғ…еҶөпјҢеҢ…иЈ…ж ҮиҜҶ规иҢғжғ…еҶөпјҢжЈҖйӘҢи®ҫж–Ҫе®ҢеӨҮжғ…еҶөпјҢйҮҮиҙӯгҖҒжЈҖжөӢе’Ңз”ҹдә§и®°еҪ•жҳҜеҗҰйҪҗе…ЁпјҢеҮҖеҢ–и®ҫж–ҪжҳҜеҗҰжҢҒз»ӯиҝҗиЎҢ并иҫҫеҲ°и§„е®ҡиҰҒжұӮпјҢдә§е“Ғзҡ„еҸҜиҝҪжәҜжҖ§пјҢйЎҫе®ўзҡ„жҠұжҖЁеҸҠеӨ„зҗҶи®°еҪ•гҖҒдёҚиүҜдәӢ件зӣ‘жөӢи®°еҪ•зӯүгҖӮ
еҜ№й«ҳйЈҺйҷ©еҢ»з–—еҷЁжў°дҪҝз”ЁеҚ•дҪҚйҮҚзӮ№жЈҖжҹҘдә§е“Ғиҝӣиҙ§жё йҒ“жҳҜеҗҰеҗҲжі•пјҢжҳҜеҗҰдҪҝз”Ёж— дә§е“ҒжіЁеҶҢиҜҒд№ҰгҖҒж— еҗҲж јиҜҒжҳҺгҖҒиҝҮжңҹгҖҒеӨұж•ҲжҲ–иҖ…ж·ҳжұ°зҡ„еҢ»з–—еҷЁжў°пјҢиҙӯиҝӣйӘҢ收记еҪ•жҳҜеҗҰе»әз«ӢпјҢжӨҚе…ҘжҖ§еҢ»з–—еҷЁжў°зҡ„дҪҝз”ЁжҳҜеҗҰе»әз«Ӣ并дҝқеӯҳеҸҜиҝҪжәҜзҡ„дҪҝз”Ёи®°еҪ•пјҢи®ҫеӨҮзұ»еҢ»з–—еҷЁжў°жҳҜеҗҰе»әз«Ӣз®ЎзҗҶжЎЈжЎҲпјҢе®ҡжңҹж ЎйӘҢгҖҒе…»жҠӨпјҢ并еҒҡи®°еҪ•зӯүгҖӮд»Ҙй«ҳйЈҺйҷ©дә§е“ҒдёәеҲҮе…ҘзӮ№пјҢд»ҘжЈҖжҹҘеңЁз”ЁеҢ»з–—еҷЁжў°зҡ„жқҘжәҗдёәйҮҚзӮ№пјҢдёҘжҠҠеҢ»з–—еҷЁжў°дҪҝз”ЁзҺҜиҠӮе…іпјҢзЎ®дҝқжЈҖжҹҘе·ҘдҪңеҸ–еҫ—е®һж•ҲпјҢеҜ№жң¬иҫ–еҢәеҶ…дәҢзә§д»ҘдёҠеҢ»з–—жңәжһ„иҝӣиЎҢжЈҖжҹҘ并еҒҡзӣёе…іи®°еҪ•пјҢжЈҖжҹҘиҰҶзӣ–зҺҮиҫҫеҲ°100%пјҢеҜ№жЈҖжҹҘдёӯеҸ‘зҺ°зҡ„й—®йўҳиҙЈд»Өйҷҗжңҹж”№жӯЈпјҢж¶үе«Ңиҝқжі•иҝқ规问йўҳзҡ„еҸҠж—¶дҫқжі•еӨ„зҗҶгҖӮ
дёүгҖҒжүҺе®һжҺЁиЎҢз”ҹдә§дјҒдёҡиҙЁйҮҸеҸ—жқғдәәеҲ¶еәҰ
继з»ӯжҺЁиЎҢеҢ»з–—еҷЁжў°з”ҹдә§дјҒдёҡиҙЁйҮҸеҸ—жқғдәәеҲ¶еәҰпјӣеңЁж—Ҙеёёзӣ‘зқЈжЈҖжҹҘдёӯпјҢе°ҶиҙЁйҮҸеҸ—жқғдәәеҲ¶еәҰзҡ„жү§иЎҢжғ…еҶөдёҺдјҒдёҡзҡ„дҝЎз”ЁиҜ„зә§з»“еҗҲиө·жқҘпјҢзЎ®дҝқиҙЁйҮҸеҸ—жқғдәәеҲ¶еәҰзҡ„ж–ҪиЎҢгҖӮе®һж–ҪеҢ»з–—еҷЁжў°з”ҹдә§дјҒдёҡиҙЁйҮҸйЈҺйҷ©иҜ„дј°е·ҘдҪңпјҢжҺЁиҝӣиҜҡдҝЎдҪ“зі»е»әи®ҫпјҢеҲҮе®һеўһејәзӣ‘з®Ўе·ҘдҪңзҡ„科еӯҰжҖ§гҖҒй’ҲеҜ№жҖ§гҖҒжңүж•ҲжҖ§гҖӮ
еӣӣгҖҒ继з»ӯејҖеұ•з”ҹдә§дјҒдёҡж—Ҙеёёзӣ‘зқЈжЈҖжҹҘиҜ„зә§е·ҘдҪң
жҢүз…§гҖҠзңҒеҢ»з–—еҷЁжў°з”ҹдә§дјҒдёҡж—Ҙеёёзӣ‘зқЈз®ЎзҗҶеҠһжі•гҖӢзҡ„规е®ҡпјҢеҜ№йҮҚзӮ№зӣ‘з®Ўзҡ„еҢ»з–—еҷЁжў°дә§е“Ғз”ҹдә§дјҒдёҡжҜҸеҚҠе№ҙжЈҖжҹҘдёҖж¬ЎпјҢеҜ№е…¶д»–дәҢгҖҒдёүзұ»еҢ»з–—еҷЁжў°з”ҹдә§дјҒдёҡжҜҸе№ҙзӣ‘зқЈжЈҖжҹҘдёҖж¬ЎгҖӮжҺЁиҝӣж—Ҙеёёзӣ‘з®ЎиҙЈд»»еҲ¶гҖҒзқЈжҹҘеҲ¶е’Ңи·ҹиёӘеҲ¶зҡ„иҗҪе®һпјҢдёҘж јиҗҪе®һзјәйҷ·зҡ„и·ҹиёӘжЈҖжҹҘпјҢеҪ»еә•ж¶ҲйҷӨиҙЁйҮҸе®үе…ЁйҡҗжӮЈпјӣеҠ ејәеҜ№йҮҚзӮ№е“Ғз§ҚгҖҒе…ій”®зҺҜиҠӮзҡ„дё“йЎ№жЈҖжҹҘе’ҢдјҒдёҡж—Ҙеёёз”ҹдә§иҙЁйҮҸжғ…еҶөжңҲжҠҘе‘ҠгҖҒеӯЈжҠҘе‘ҠеҲ¶еәҰзҡ„жү§иЎҢгҖӮ
дә”гҖҒеҲҮе®һеҠ ејәеҢ»з–—еҷЁжў°зҡ„жіЁеҶҢе·ҘдҪң
дёҘж јжҢүз…§гҖҠеўғеҶ…第дёҖзұ»еҢ»з–—еҷЁжў°жіЁеҶҢе®Ўжү№ж“ҚдҪң规иҢғгҖӢзҡ„иҰҒжұӮпјҢе®ЎжҹҘжү№еҮҶ第дёҖзұ»еҢ»з–—еҷЁжў°зҡ„жіЁеҶҢпјҢи®ӨзңҹеҒҡеҘҪеҢ»з–—еҷЁжў°жіЁеҶҢзҡ„зҺ°еңәж ёжҹҘе’ҢдёҙеәҠж ёжҹҘе·ҘдҪңгҖӮ
е…ӯгҖҒеӨ§еҠӣ规иҢғйҮҚзӮ№зӣ‘з®ЎеҢ»з–—еҷЁжў°з»ҸиҗҘ秩еәҸ
еҜ№йҮҚзӮ№зӣ‘з®ЎеҢ»з–—еҷЁжў°з»ҸиҗҘдјҒдёҡйҮҚзӮ№жЈҖжҹҘдјҒдёҡжҳҜеҗҰжҢүз…§и®ёеҸҜиҜҒж ёе®ҡзҡ„з»ҸиҗҘиҢғеӣҙгҖҒжіЁеҶҢең°еқҖгҖҒд»“еә“ең°еқҖгҖҒжңүж•Ҳжңҹйҷҗзӯүд»ҺдәӢз»ҸиҗҘжҙ»еҠЁпјҢдә§е“Ғиҝӣиҙ§жё йҒ“жҳҜеҗҰеҗҲжі•пјҢжҳҜеҗҰж“…иҮӘйҷҚдҪҺжҲ‘зңҒеҢ»з–—еҷЁжў°з»ҸиҗҘдјҒдёҡжЈҖжҹҘйӘҢ收ж ҮеҮҶеҜ№дјҒдёҡзҡ„иҙЁйҮҸз®ЎзҗҶдәәе‘ҳгҖҒе”®еҗҺжңҚеҠЎдәәе‘ҳгҖҒз®ЎзҗҶеҲ¶еәҰгҖҒеңәең°зҺҜеўғгҖҒд»“еә“еӯҳеӮЁи®ҫж–Ҫи®ҫеӨҮзӯүз»ҸиҗҘжқЎд»¶зҡ„иҰҒжұӮзӯүгҖӮеҠ еӨ§еҜ№йҮҚзӮ№жЈҖжҹҘеҜ№иұЎзҡ„ж—ҘеёёжЈҖжҹҘйў‘ж¬ЎпјҢеҜ№йҮҚзӮ№жЈҖжҹҘеҜ№иұЎеә”дҝқиҜҒзҺ°еңәжЈҖжҹҘиҰҶзӣ–зҺҮиҮіе°‘иҫҫеҲ°100пј…пјҢеҜ№жЈҖжҹҘдёӯеҸ‘зҺ°зҡ„й—®йўҳиҙЈд»Өе…¶йҷҗжңҹж”№жӯЈпјҢж¶үе«Ңиҝқжі•иҝқ规问йўҳзҡ„еҸҠж—¶иҝӣиЎҢеӨ„зҗҶпјҢзЎ®дҝқж—Ҙеёёзӣ‘зқЈжЈҖжҹҘе·ҘдҪңеҸ–еҫ—е®һж•ҲгҖӮ
дёғгҖҒз§ҜжһҒжҺЁиҝӣеҢ»з–—еҷЁжў°зӣ‘з®ЎдҝЎжҒҜеҢ–е»әи®ҫ
е…«гҖҒи®ӨзңҹжҠ“еҘҪзӣ‘з®Ўдәәе‘ҳеҹ№и®ӯе·ҘдҪң
з»„з»Үзӣ‘з®Ўдәәе‘ҳеҸӮеҠ зңҒеұҖзҡ„еҗ„з§Қеҹ№и®ӯпјҢе°Өе…¶жҳҜеҢ»з–—еҷЁжў°з”ҹдә§иҙЁйҮҸ规иҢғзҡ„еҹ№и®ӯпјҢеҗҢж—¶еҠ ејәеҜ№дјҒдёҡзӣёе…ідәәе‘ҳзҡ„еҹ№и®ӯгҖӮ
д№қгҖҒ继з»ӯжҠ“еҘҪеҢ»з–—еҷЁжў°дёҚиүҜдәӢ件зӣ‘жөӢе·ҘдҪң
иҝӣдёҖжӯҘе®Ңе–„еҢ»з–—еҷЁжў°дёҚиүҜдәӢ件зӣ‘жөӢе·ҘдҪңпјҢжҢүз…§зңҒгҖҒеёӮеұҖзҡ„иҰҒжұӮпјҢеҠӘеҠӣе®ҢжҲҗд»Ҡе№ҙзҡ„еҢ»з–—еҷЁжў°дёҚиүҜдәӢ件зӣ‘жөӢзӣ®ж ҮгҖӮ
第3зҜҮдёҖгҖҒж·ұе…ҘејҖеұ•еҗ„йЎ№дё“йЎ№ж•ҙжІ»
пјҲдёҖпјүеҠ ејәйӨҗйҘ®жңҚеҠЎдё“йЎ№ж•ҙжІ»гҖӮи®ӨзңҹиҙҜеҪ»гҖҠйӨҗйҘ®жңҚеҠЎйЈҹе“Ғе®үе…Ёзӣ‘зқЈз®ЎзҗҶеҠһжі•гҖӢпјҢиҗҪе®һе®үе…Ёз®ЎзҗҶеҲ¶еәҰпјҢеҠ еӨ§ж—Ҙеёёзӣ‘зқЈжЈҖжҹҘпјҢеҠ ејәеҜ№еӯҰж ЎйЈҹе ӮгҖҒе»әзӯ‘е·Ҙең°йЈҹе ӮгҖҒеҶң家д№җж—…жёёзӮ№гҖҒе°ҸеһӢйӨҗйҘ®еҚ•дҪҚзӯүжңҚеҠЎз§©еәҸзҡ„ж•ҙйЎҝпјҢеҠ еӨ§зӣ’йҘӯзӯүй«ҳйЈҺйҷ©йЈҹе“Ғе’ҢйӨҗе…·жё…жҙ—ж¶ҲжҜ’зӯүйҮҚзӮ№зҺҜиҠӮзҡ„зӣ‘зқЈжЈҖжҹҘеҠӣеәҰгҖӮдёҘеҺүжҹҘеӨ„йӨҗйҘ®еҚ•дҪҚж— иҜҒз»ҸиҗҘиЎҢдёәпјҢдёҘеҺүжү“еҮ»ж·»еҠ йқһйЈҹз”Ёзү©иҙЁгҖҒж»Ҙз”ЁйЈҹе“Ғж·»еҠ еүӮгҖҒйҮҮиҙӯдҪҝз”Ёз—…жӯ»жҲ–иҖ…жӯ»еӣ дёҚжҳҺзҡ„з•ңзҰҪеҸҠе…¶еҲ¶е“ҒгҖҒеҠЈиҙЁйЈҹз”ЁжІ№зӯүиҝқжі•иЎҢдёәгҖӮеҒҡеҘҪйҮҚеӨ§иҠӮеәҶжңҹй—ҙйЈҹе“Ғе®үе…Ёдҝқйҡңе·ҘдҪңгҖӮ
пјҲдәҢпјү继з»ӯж·ұе…ҘејҖеұ•йқһиҚҜе“ҒеҶ’е……иҚҜе“Ғзҡ„дё“йЎ№ж•ҙжІ»е·ҘдҪңгҖӮеңЁ2016е№ҙе……еҲҶи°ғжҹҘж‘ёеә•е№¶дё”е·Із»ҸеҗҜеҠЁж•ҙжІ»е·ҘдҪңзҡ„еҹәзЎҖдёҠпјҢ继з»ӯејҖеұ•еҜ№иҚҜе“Ғзӯүдә§е“Ғз”ҹдә§гҖҒз»ҸиҗҘгҖҒдҪҝз”ЁеҚ•дҪҚйқһиҚҜе“ҒеҶ’е……иҚҜе“ҒиЎҢдёәзҡ„ж•ҙжІ»пјҢдҫқжі•жү“еҮ»йқһиҚҜе“ҒеҶ’е……иҚҜе“Ғзҡ„иҝқжі•иЎҢдёәгҖӮ
пјҲдёүпјүејҖеұ•еҜ№й«ҳйЈҺйҷ©еҢ»з–—еҷЁжў°дё“йЎ№ж•ҙжІ»иЎҢеҠЁгҖӮй’ҲеҜ№еҢ»з–—еҷЁжў°еӯҳеңЁзҡ„й—®йўҳе’ҢзӨҫдјҡеҸҚжҳ ејәзғҲзҡ„й—®йўҳпјҢеқҡжҢҒд»Ҙй«ҳйЈҺйҷ©еҢ»з–—еҷЁжў°дёәйҮҚзӮ№ејҖеұ•дё“йЎ№жЈҖжҹҘпјҢиҝӣдёҖжӯҘ规иҢғеҢ»з–—еҷЁжў°з”ҹдә§гҖҒз»ҸиҗҘгҖҒдҪҝз”ЁзҺҜиҠӮ秩еәҸпјҢе®һзҺ°й•ҝж•Ҳзӣ‘з®ЎгҖӮ
пјҲеӣӣпјүејҖеұ•дҝқеҒҘйЈҹе“ҒгҖҒеҢ–еҰҶе“Ғдё“йЎ№ж•ҙйЎҝгҖӮдёҘеҺүжү“еҮ»дҝқеҒҘйЈҹе“Ғз”ҹдә§дјҒдёҡдә§е“Ғиҝқжі•ж·»еҠ еҢ–еӯҰжҲҗеҲҶгҖҒж— иҜҒз”ҹдә§гҖҒеҘ—еҸ·з”ҹдә§гҖҒеӨёеӨ§е®Јдј зӯүиЎҢдёәгҖӮејҖеұ•еӨ§еһӢеҢ–еҰҶе“Ғжү№еҸ‘еёӮеңәзӯүз»ҸиҗҘдјҒдёҡжЈҖжҹҘпјҢйҮҚзӮ№жҹҘеӨ„еҢ–еҰҶе“Ғз”ҹдә§дјҒдёҡж·»еҠ зҰҒз”Ёзү©иҙЁгҖҒи¶…иҢғеӣҙдҪҝз”Ёйҷҗз”Ёзү©иҙЁе’Ңж— иҜҒз”ҹдә§зӯүиЎҢдёәгҖӮ
пјҲдә”пјүејҖеұ•иҝқжі•е№ҝе‘Ҡдё“йЎ№ж•ҙжІ»гҖӮеҜ№еҸ‘еёғе…¬дј—дәәзү©д»ЈиЁҖгҖҒиҚҜе“ҒеӨёеӨ§е®Јдј гҖҒдҝқеҒҘйЈҹе“Ғе®Јдј з–—ж•ҲгҖҒйқһиҚҜе“ҒеҶ’е……иҚҜе“Ғзӯүиҝқжі•е№ҝе‘ҠеҠ еӨ§ж•ҙжІ»еҠӣеәҰгҖӮеҜ№еҸ‘еёғиҝқжі•иҚҜе“ҒдҝЎжҒҜзҡ„з”ҹдә§з»ҸиҗҘдјҒдёҡзҡ„дә§е“Ғдҫқжі•иҜҘжҹҘеӨ„зҡ„жҹҘеӨ„пјҢиҜҘж’Өжҹңзҡ„ж’ӨжҹңгҖӮ
дәҢгҖҒжҠ“еҘҪеӨ§жЎҲиҰҒжЎҲзҡ„жҹҘеӨ„
еҠ ејәдёҺе…¬е®үгҖҒеҚ«з”ҹгҖҒиҙЁзӣ‘гҖҒе·Ҙе•ҶгҖҒйӮ®ж”ҝзӯүйғЁй—Ёзҡ„й…ҚеҗҲпјҢе»әз«ӢдҝЎжҒҜдәӨжөҒеҲ¶еәҰпјҢеҠӘеҠӣжҗӯе»әжү“еҒҮжІ»еҠЈе№іеҸ°пјҢе»әз«ӢдёҖеҘ—жңүеҲ©дәҺйЈҹе“ҒгҖҒиҚҜе“ҒгҖҒдҝқеҒҘйЈҹе“ҒгҖҒеҢ–еҰҶе“Ғзӯүдә§е“Ғжү“еҒҮжІ»еҠЈзҡ„иЎҢд№Ӣжңүж•Ҳзҡ„жңәеҲ¶гҖӮиҰҒдёҘж јжҢүз…§иҚҜе“Ғзӯүзӣёе…ідә§е“Ғж¶үеҸҠеҲ‘жі•зҡ„жңү关规е®ҡд»ҘеҸҠ2016е№ҙдёӨй«ҳеҸёжі•и§ЈйҮҠжңү关规е®ҡпјҢеҒҡеҲ°жЎҲ件иҜҘ移дәӨзҡ„移дәӨпјҢд»ҺеҝғзҗҶдёҠз»ҷдәҲж¶үиҚҜзӯүзӣёе…ідә§е“Ғиҝқжі•зҠҜзҪӘеҲҶеӯҗд»ҘйңҮж‘„гҖӮ
дёүгҖҒе®һж–ҪеҜ№й«ҳйЈҺйҷ©дјҒдёҡгҖҒй«ҳйЈҺйҷ©дә§е“Ғзҡ„еҠЁжҖҒзӣ‘жҺ§
еҜ№дәҺд»ҘеҫҖеұҘж¬ЎеҸ‘з”ҹиҝқжі•з”ҹдә§гҖҒз»ҸиҗҘе’ҢдҪҝз”ЁиҚҜе“ҒгҖҒеҢ»з–—еҷЁжў°иҝқжі•иЎҢдёәзҡ„дјҒдёҡд»ҘеҸҠж¶үеҸҠй«ҳйЈҺйҷ©дә§е“Ғзҡ„дјҒдёҡпјҢиҰҒеҠ еӨ§еҠЁжҖҒзӣ‘з®ЎеҠӣеәҰпјҢеңЁзӣ‘з®ЎдёҠеҠӘеҠӣеҒҡеҲ°вҖңдёүеӨҡвҖқпјҢеҚіеӨҡеҲ°дҪҚпјҢеӨҡжЈҖжҹҘпјҢеӨҡжҠҪжЈҖгҖӮеҗҢж—¶пјҢеҜ№дәҺз”ҹдә§гҖҒй”Җе”®е’ҢдҪҝз”Ёдёүзұ»еҢ»з–—еҷЁжў°гҖҒжіЁе°„еүӮгҖҒз–«иӢ—гҖҒиЎҖж¶ІеҲ¶е“ҒгҖҒз”ҹзү©еҲ¶е“ҒгҖҒеӯ•еҰҮз”Ёдә§е“ҒгҖҒе„ҝз«Ҙз”Ёдә§е“Ғзӯүй«ҳйЈҺйҷ©дә§е“ҒпјҢиҰҒеҒҡдёәзӣ‘з®Ўзҡ„йҮҚзӮ№е“Ғз§ҚпјҢеҠ еӨ§зӣ‘з®ЎеҠӣеәҰгҖӮ
еӣӣгҖҒеҠ еӨ§еҜ№ж— дёҡдәәе‘ҳж— иҜҒй”Җе”®иҚҜе“Ғзҡ„жҹҘеӨ„еҠӣеәҰпјҢ规иҢғиҚҜе“Ғиҙӯй”Җжё йҒ“
зҺ°еңЁдёҖдәӣдјҒдёҡдёӢеІ—дәәе‘ҳпјҢзһ„еҮҶиҚҜе“Ғй”Җе”®жңүеҲ©еҸҜеӣҫпјҢдјӘйҖ иҷҡеҒҮзҡ„жүӢз»ӯпјҢжҲ–иҖ…жҢӮйқ жӯЈи§„зҡ„иҚҜе“Ғз»ҸиҗҘйғЁй—ЁпјҢеҲ°еӨ„д№ұй”ҖиҚҜе“ҒпјҢд№ҹдҪҝеҫ—еҒҮеҠЈиҚҜе“ҒеӨ§иЎҢе…¶йҒ“гҖӮеӣ жӯӨпјҢеҝ…йЎ»еҠ еӨ§еҜ№ж¶үиҚҜеҚ•дҪҚиҙӯиҝӣжё йҒ“зҡ„зӣ‘з®ЎпјҢд»Һж №жәҗдёҠжқңз»қеҒҮеҠЈиҚҜе“ҒжөҒе…ҘеёӮеңәгҖӮ
дә”гҖҒиҝӣдёҖжӯҘеҒҡеҘҪжҠҪйӘҢе·ҘдҪңпјҢжңүй’ҲеҜ№жҖ§ең°еҜ№й«ҳйЈҺйҷ©дә§е“ҒеҠ еӨ§жҠҪйӘҢеҠӣеәҰ
жҢүз…§еӣҪ家гҖҠе…ідәҺеҠ ејәеҹәжң¬иҚҜзү©иҙЁйҮҸзӣ‘зқЈз®ЎзҗҶзҡ„规е®ҡгҖӢиҰҒжұӮпјҢиҰҒеҠ еӨ§еҜ№жөҒйҖҡе’ҢдҪҝз”ЁзҺҜиҠӮеҹәжң¬иҚҜзү©зҡ„зӣ‘зқЈжҠҪйӘҢгҖӮеҠ еӨ§еҜ№й«ҳйЈҺйҷ©иҚҜе“ҒгҖҒиҙЁйҮҸеҸҜз–‘иҚҜе“Ғзҡ„иҙЁйҮҸзӣ‘зқЈжҠҪйӘҢеҠӣеәҰгҖӮеҠ ејәеҜ№еҮҸиӮҘзұ»гҖҒйҷҚзі–зұ»гҖҒжҠ—з–ІеҠізұ»зӯүдҝқеҒҘйЈҹе“Ғзҡ„зӣ‘зқЈжҠҪйӘҢгҖӮеҒҡеҘҪеҢ–еҰҶе“Ғе“Ғз§Қзҡ„жҠҪжЈҖе·ҘдҪңгҖӮ
е…ӯгҖҒеҠ ејәзЁҪжҹҘиғҪеҠӣе»әи®ҫ
пјҲдёҖпјү规иҢғе·ҘдҪңеҲ¶еәҰе’ҢзЁӢеәҸпјҢ规иҢғжү§жі•иЎҢдёәгҖӮе®Ңе–„зЁҪжҹҘеҶ…йғЁеҲ¶еәҰе»әи®ҫпјҢ规иҢғжү§жі•дәәе‘ҳзҡ„иЎҢдёәгҖӮе®Ңе–„жҠ•иҜүдёҫжҠҘе·ҘдҪңеҲ¶еәҰпјҢе»әз«ӢжЎЈжЎҲпјҢејәеҢ–жҠ•иҜүдёҫжҠҘеҸ—зҗҶе·ҘдҪңпјҢеҜҶеҲҮдёҺзҫӨдј—иҒ”зі»гҖӮеҠ ејәеҜ№зЁҪжҹҘжү§жі•дәәе‘ҳжі•еҫӢ法规еҹ№и®ӯпјҢеҒҡеҲ°жҜҸдёӘзЁҪжҹҘдәәе‘ҳиғҪеӨҹзҶҹз»ғеӨ„зҗҶеҗ„йЎ№еә”жҖҘй—®йўҳпјҢдёҚж–ӯжҸҗй«ҳзЁҪжҹҘдәәе‘ҳзҡ„дёҡеҠЎзҙ иҙЁпјҢжҸҗй«ҳдәәе‘ҳзҡ„еҠһжЎҲиғҪеҠӣгҖӮ
пјҲдәҢпјүдҫқжі•еҠһжЎҲпјҢи®ӨзңҹеҪ’жЎЈпјҢжҸҗй«ҳзЁҪжҹҘжЎҲеҚ·иҙЁйҮҸгҖӮзңҒеұҖе°ҶеңЁд»Ҡе№ҙеҜ№йғЁеҲҶеёӮгҖҒеҺҝзЁҪжҹҘжЎҲеҚ·иҙЁйҮҸжғ…еҶөејҖеұ•иҜ„жҹҘе·ҘдҪңгҖӮжҲ‘еұҖе°ҶеңЁе№ҙеҶ…еҒҡеҘҪиҮӘжҹҘе·ҘдҪңгҖӮеңЁжү§жі•е·ҘдҪңдёӯпјҢжҜҸдёӘзЁҪжҹҘеҠһжЎҲдәәе‘ҳйғҪиҰҒзҶҹжӮүеҠһжЎҲгҖҒжЎҲеҚ·еҪ’жЎЈгҖҒж–Үд№ҰеҲ¶дҪңд»ҘеҸҠжңүе…іжі•еҫӢ法规зҡ„йҖӮз”ЁгҖӮзү№еҲ«иҰҒйҮҚи§ҶдёҖиҲ¬зЁӢеәҸжЎҲеҚ·зҡ„еҲ¶дҪңпјҢеҠӣдәүжҠҠжҜҸдёҖдёӘжЎҲ件йғҪеҠһжҲҗз»Ҹеҫ—иө·жҺЁж•Іе’ҢиҖғйӘҢзҡ„й“ҒжЎҲпјҢеҠһжҲҗз»Ҹеҫ—иө·дёҠзә§йғЁй—ЁжЈҖжҹҘзҡ„дјҳз§ҖжЎҲеҚ·гҖӮ
пјҲдёүпјүз§ҜжһҒеҮҶеӨҮеҸӮеҠ е…ЁзңҒйҰ–еұҠиҚҜе“ҒжЈҖжөӢиҪҰжЈҖжөӢжҠҖжңҜжҜ”жӯҰжҙ»еҠЁгҖӮжҜ”жӯҰеҲҶзҗҶи®әиҖғиҜ•е’Ңе®һйӘҢж“ҚдҪңдёӨдёӘйғЁеҲҶгҖӮ第дёҖйғЁеҲҶдёәзҗҶи®әиҖғиҜ•пјҢдё»иҰҒеҶ…е®№жҳҜпјҡиҪҰиҪҪеҗ„зі»з»ҹеҹ№и®ӯж•ҷжқҗзӯүжңүе…іеҹәжң¬зҹҘиҜҶе’Ңеҹәжң¬жҠҖжңҜ规иҢғпјӣ第дәҢйғЁеҲҶдёәе®һйҷ…ж“ҚдҪңпјҢйҮҚзӮ№иҖғжҹҘеҸӮиөӣйҖүжүӢеҜ№иҝ‘зәўеӨ–иҝҗз”Ёе’ҢиҮӘдё»е»әжЁЎзӯүж–№йқўзҡ„еҹәжң¬жҠҖиғҪгҖӮеёӮеұҖе°ҶеңЁйҖүе®ҡеҸӮиөӣйҖүжүӢеҗҺпјҢеҠ ејәжңүй’ҲеҜ№жҖ§зҡ„еҹ№и®ӯе’ҢеӯҰд№ пјҢеҠӣдәүеңЁе…ЁзңҒжҜ”жӯҰжҜ”иөӣдёӯеҸ–еҫ—еҘҪжҲҗз»©гҖӮ
дёғгҖҒеҠ ејәзЁҪжҹҘйҳҹдјҚзҡ„е…ҡйЈҺе»үж”ҝе»әи®ҫе’ҢиЎҢйЈҺе»әи®ҫ
еңЁзЁҪжҹҘжү§жі•йҳҹдјҚдёӯж·ұе…ҘејҖеұ•еҸҚи…җеҖЎе»үж•ҷиӮІпјҢдёҚеҠһе…ізі»жЎҲгҖҒдәәжғ…жЎҲпјҢдёҚеҗғжӢҝеҚЎиҰҒпјҢеҠ ејәиЎҢйЈҺе»әи®ҫпјҢејәеҢ–жңҚеҠЎж„ҸиҜҶпјҢеқҡжҢҒзҫӨдј—ж»Ўж„Ҹж ҮеҮҶгҖӮ规иҢғжү§жі•иЎҢдёәпјҢжҸҗй«ҳеҠһжЎҲж•ҲзҺҮпјҢеҠӘеҠӣеЎ‘йҖ дёҖж”Ҝж”ҝжІ»иҝҮзЎ¬гҖҒдҪңйЈҺе»үжҙҒгҖҒзәӘеҫӢдёҘжҳҺгҖҒдёҡеҠЎзІҫиүҜзҡ„зЁҪжҹҘйҳҹдјҚпјҢж ‘з«ӢйЈҹе“ҒиҚҜе“ҒзЁҪжҹҘжү§жі•иүҜеҘҪеҪўиұЎгҖӮ
第4зҜҮдёҖгҖҒеҠ ејәйўҶеҜјпјҢжҸҗй«ҳи®ӨиҜҶпјҢдёҚж–ӯе®Ңе–„зӣ‘жөӢдҪ“зі»
иҚҜе“ҒдёҚиүҜеҸҚеә”е’ҢеҢ»з–—еҷЁжў°дёҚиүҜдәӢ件зӣ‘жөӢе…ізі»еҲ°е№ҝеӨ§дәәж°‘з”ЁиҚҜз”Ёжў°е®үе…ЁпјҢжҳҜдёҖйЎ№йӣҶдё“дёҡгҖҒжҠҖжңҜгҖҒз®ЎзҗҶдәҺдёҖдҪ“зҡ„з»јеҗҲжҖ§е·ҘдҪңгҖӮеҗ„зӣ‘жөӢеҚ•дҪҚиҰҒй«ҳеәҰйҮҚи§ҶпјҢеҠ ејәйўҶеҜјпјҢжҳҺзЎ®иҙЈд»»пјҢеҲ¶е®ҡзӣ®ж ҮпјҢ规иҢғзЁӢеәҸпјҢиҝӣдёҖжӯҘеЈ®еӨ§зӣ‘жөӢжҠҖжңҜжңәжһ„еҠӣйҮҸпјҢжҸҗй«ҳзӣ‘жөӢе·ҘдҪңж°ҙе№іпјҢдёҚж–ӯе®Ңе–„зӣ‘жөӢдҪ“зі»е’ҢжҠҘе‘ҠеҲ¶еәҰпјҢдҝғиҝӣжҲ‘еёӮиҚҜе“ҒдёҚиүҜеҸҚеә”е’ҢеҢ»з–—еҷЁжў°дёҚиүҜдәӢ件зӣ‘жөӢе·ҘдҪңеҒҘеә·еҸ‘еұ•гҖӮдёәеҒҡеҘҪиҝҷйЎ№е·ҘдҪңпјҢеёӮеұҖеҚ°еҸ‘дәҶгҖҠе…ідәҺеҠ ејә2016е№ҙиҚҜе“ҒдёҚиүҜеҸҚеә”е’ҢеҢ»з–—еҷЁжў°дёҚиүҜдәӢ件зӣ‘жөӢе·ҘдҪңзҡ„йҖҡзҹҘгҖӢпјҢжҠҠд»»еҠЎеҲҶи§ЈеҲ°дәҶеҗ„еёӮеҢәеұҖпјҲеҲҶеұҖпјүе’ҢеёӮеұҖзЁҪжҹҘеӨ§йҳҹгҖҒиҚҜе“Ғ科гҖҒеҷЁжў°з§‘зӯүдёҡеҠЎз§‘е®ӨпјҢеҗ„еёӮеҢәеұҖпјҲеҲҶеұҖпјүе’ҢеёӮеұҖжңүе…ідёҡеҠЎз§‘е®ӨиҰҒеҗ„еҸёе…¶иҒҢпјҢйҪҗжҠ“е…ұз®ЎпјҢе®ҢжҲҗеҗ„иҮӘе·ҘдҪңзӣ®ж ҮгҖӮ
дәҢгҖҒеҠ еӨ§е®Јдј еҹ№и®ӯеҠӣеәҰ
еҗ„зӣ‘жөӢеҚ•дҪҚиҰҒеҠ ејәиҚҜе“ҒдёҚиүҜеҸҚеә”е’ҢеҢ»з–—еҷЁжў°дёҚиүҜдәӢ件зӣ‘жөӢзҡ„е®Јдј гҖҒеҹ№и®ӯе’ҢжҢҮеҜје·ҘдҪңпјҢеҲ©з”ЁжҠҘзәёгҖҒз”өеҸ°гҖҒз”өи§ҶеҸ°гҖҒзҪ‘з»ңзӯүеӨҡз§ҚеӘ’дҪ“пјҢжү©еӨ§е®Јдј йқўпјҢй’ҲеҜ№еҗ„еҚ•дҪҚеӯҳеңЁзҡ„й—®йўҳпјҢе®ҡжңҹжҲ–дёҚе®ҡжңҹдёҫеҠһеҗ„з§ҚеҪўејҸзҡ„еҹ№и®ӯзҸӯпјҢжҸҗй«ҳзӣ‘жөӢдәәе‘ҳзҡ„дё“дёҡжҠҖжңҜж°ҙе№ігҖӮиҰҒе……еҲҶеҲ©з”ЁеёӮеұҖзҪ‘з«ҷдёӯзҡ„иҚҜжў°е®үе…ЁжҖ§зӣ‘жөӢж Ҹзӣ®пјҢеҗ„зә§зӣ‘жөӢжңәжһ„иҰҒиёҠи·ғжҠ•зЁҝпјҢеҸҠж—¶жҠҘйҖҒе·ҘдҪңеҠЁжҖҒд»ҘеҸҠеҘҪеҒҡжі•гҖҒеҘҪз»ҸйӘҢгҖӮ
дёүгҖҒжҸҗй«ҳз—…дҫӢжҠҘе‘ҠеҚ•дҪҚж•°йҮҸ
й’ҲеҜ№жҲ‘еёӮжҠҘе‘ҠеҚ•дҪҚж•°иҫғе°‘зҡ„жғ…еҶөпјҢеёӮдёӯеҝғе’Ңеҗ„еёӮеҢәеұҖпјҲеҲҶеұҖпјүзӣ‘жөӢз«ҷиҰҒ继з»ӯжү©еӨ§иҫ–еҢәеҶ…зӣ‘жөӢзҪ‘з»ңиҰҶзӣ–зҺҮпјҢе°Ҷзӣ‘жөӢзҪ‘з»ңиҝӣдёҖжӯҘеҗ‘еҹәеұӮ延伸пјҢе°Өе…¶иҰҒеҠ ејәеҜ№иҚҜе“Ғз”ҹдә§гҖҒз»ҸиҗҘеҚ•дҪҚе’ҢеҢ»з–—иҜҠжүҖиҚҜе“ҒдёҚиүҜеҸҚеә”зӣ‘жөӢе·ҘдҪңзҡ„жҢҮеҜје’ҢзқЈдҝғпјҢжҸҗй«ҳжҲ‘еёӮжҠҘе‘ҠеҚ•дҪҚж•°йҮҸпјҢдҪҝжҲ‘еёӮзҡ„иҚҜе“ҒдёҚиүҜеҸҚеә”зӣ‘жөӢе·ҘдҪңеқҮиЎЎеҸ‘еұ•гҖӮ
еӣӣгҖҒжҸҗй«ҳжҠҘе‘Ҡзҡ„ж•°йҮҸе’ҢиҙЁйҮҸ
еҗ„еҚ•дҪҚиҰҒиҝӣдёҖжӯҘе®Ңе–„иҚҜе“ҒдёҚиүҜеҸҚеә”зӣ‘жөӢдҪ“зі»пјҢеқҡжҢҒжҠҘе‘Ҡж•°йҮҸе’ҢиҙЁйҮҸ并йҮҚзҡ„еҺҹеҲҷпјҢеңЁдёҚж–ӯжҸҗй«ҳжҠҘе‘Ҡж•°йҮҸзҡ„еҹәзЎҖдёҠпјҢиҝӣдёҖжӯҘжҸҗй«ҳжҠҘе‘Ҡзҡ„规иҢғжҖ§е’Ң科еӯҰжҖ§гҖӮеҗ„еёӮеҢәеұҖпјҲеҲҶеұҖпјүзӣ‘жөӢдәәе‘ҳеҜ№з—…дҫӢжҠҘе‘Ҡзҡ„иҙЁйҮҸиҰҒдёҘж јжҠҠе…іпјҢи®Өзңҹе®ЎжҹҘпјҢзҰҒжӯўиҫ–еҢәеҶ…зҡ„зӣ‘жөӢеҚ•дҪҚзӣҙжҺҘеҗ‘зңҒдёӯеҝғжҸҗдәӨз—…дҫӢжҠҘе‘ҠпјҢиҰҒжҸҗй«ҳж–°зҡ„дёҘйҮҚзҡ„з—…дҫӢжҠҘе‘ҠжҜ”дҫӢпјҢдёҚж–ӯжҸҗй«ҳжҠҘе‘ҠеҸҜеҲ©з”ЁеәҰпјҢе……еҲҶеҸ‘жҢҘеҜ№дёҙеәҠеҗҲзҗҶз”ЁиҚҜзҡ„жҢҮеҜјдҪңз”ЁгҖӮ2016е№ҙпјҢеҗ„зӣ‘жөӢеҚ•дҪҚиҚҜе“ҒдёҚиүҜеҸҚеә”з—…дҫӢжҠҘе‘Ҡдёӯж–°зҡ„дёҘйҮҚзҡ„з—…дҫӢжҠҘе‘ҠжҜ”дҫӢиҰҒиҫҫеҲ°жҠҘе‘ҠжҖ»ж•°зҡ„15пј…д»ҘдёҠгҖӮ
дә”гҖҒеҠ ејәеҢ»з–—еҷЁжў°дёҚиүҜдәӢ件зӣ‘жөӢ
еҗ„еҚ•дҪҚиҰҒй«ҳеәҰйҮҚи§ҶеҢ»з–—еҷЁжў°дёҚиүҜдәӢ件зӣ‘жөӢе·ҘдҪңпјҢеҠ ејәеҜ№еҢ»з–—еҷЁжў°дёҚиүҜдәӢ件жҠҘе‘Ҡзҡ„收йӣҶе’ҢдёҠжҠҘе·ҘдҪңпјҢеҠӘеҠӣеҮҸе°‘йӣ¶жҠҘе‘ҠеҢ»з–—жңәжһ„ж•°йҮҸпјҢеўһеҠ й«ҳйЈҺйҷ©еҷЁжў°дёҚиүҜдәӢ件зҡ„жҠҘе‘ҠжҜ”дҫӢпјҢдёҚж–ӯжҸҗй«ҳжҠҘиЎЁж•°йҮҸе’ҢиҙЁйҮҸгҖӮеҗ„еёӮеҢәеұҖпјҲеҲҶеұҖпјүзӣ‘жөӢз«ҷиҰҒеҲҮе®һжҠ“еҘҪеҢ»з–—еҷЁжў°дёҚиүҜдәӢ件зҪ‘з»ңжҠҘе‘Ҡе·ҘдҪңпјҢеҜ№иҫ–еҢәеҶ…зҡ„еҷЁжў°з”ҹдә§гҖҒз»ҸиҗҘеҸҠдҪҝз”ЁеҚ•дҪҚиҝӣиЎҢжіЁеҶҢеҸҠжҠҘиЎЁж–№жі•зҡ„еҹ№и®ӯе’ҢжҢҮеҜјпјҢдәүеҸ–е№ҙеә•еүҚе…ЁйғЁе®һзҺ°зҪ‘з»ңжҠҘиЎЁгҖӮ
第5зҜҮдёҖгҖҒиҗҪе®һе·ҘдҪңиҙЈд»»пјҢзқҖеҠӣе®Ңе–„иҖғж ёдҪ“зі»
1гҖҒеҒҘе…Ёе®Ңе–„йЈҹе“ҒиҚҜе“Ғе®үе…ЁиҙЈд»»дҪ“зі»е’Ңзӣ‘з®ЎдҪ“зі»гҖӮжҢүз…§вҖңең°ж–№ж”ҝеәңиҙҹжҖ»иҙЈгҖҒзӣ‘з®ЎйғЁй—Ёеҗ„иҙҹе…¶иҙЈгҖҒдјҒдёҡжҳҜ第дёҖиҙЈд»»дәәвҖқзҡ„иҰҒжұӮпјҢиҗҪе®һеҗ„ж–№иҙЈд»»гҖӮе»әз«ӢеҒҘе…ЁеҹәеұӮзӣ‘з®ЎзҪ‘з»ңдҪ“зі»пјҢз§ҜжһҒеҸ‘жҢҘеҹәеұӮзӣ‘зқЈе‘ҳгҖҒеҚҸз®Ўе‘ҳе’ҢдҝЎжҒҜе‘ҳдҪңз”Ёзҡ„жңүж•ҲжңәеҲ¶гҖӮ
2гҖҒе»әз«ӢиҙЈд»»зӣ®ж ҮиҖғж ёиҜ„д»·дҪ“зі»гҖӮеҠ ејәж”ҝеәңеҸҠзӣ‘з®ЎйғЁй—ЁйЈҹе“ҒиҚҜе“Ғе®үе…ЁиҙЈд»»зӣ®ж Үе®ҢжҲҗжғ…еҶөзҡ„иҖғж ёиҜ„д»·пјӣзқЈдҝғдјҒдёҡејәеҢ–第дёҖиҙЈд»»дәәж„ҸиҜҶпјҢе»әз«Ӣ并е®һж–Ҫжі•дәәд»ЈиЎЁйЈҹе“ҒиҚҜе“Ғе®үе…ЁиҙЈд»»иҝҪ究еҲ¶гҖӮ
3гҖҒе»әз«Ӣе®Ңе–„иҚҜе“Ғе®үе…ЁйЈҺйҷ©иҜ„дј°е’ҢеҲҶзә§з®ЎзҗҶжңәеҲ¶гҖӮдёҘж јжү§иЎҢгҖҠеёӮиҚҜе“Ғе®үе…ЁйЈҺйҷ©еӣ зҙ еҲҶзә§з®ЎзҗҶе®һж–Ҫж–№жЎҲпјҲиҜ•иЎҢпјүгҖӢпјҢе…ЁйқўжҺ’жҹҘйЈҹе“ҒиҚҜе“Ғе®үе…ЁйҡҗжӮЈпјҢж·ұе…ҘејҖеұ•йЈҺйҷ©еҲҶжһҗиҜ„дј°пјҢеҠ ејәйҡҗжӮЈжІ»зҗҶпјҢеҜ№йҮҚеӨ§йҡҗжӮЈе®һиЎҢжҢӮзүҢзқЈеҠһгҖӮ
4гҖҒжҺЁиҝӣиҜҡдҝЎе»әи®ҫе’ҢиҙЁйҮҸе®үе…ЁдҝЎз”Ёзӯүзә§иҜ„е®ҡе·ҘдҪңгҖӮеңЁиЎҢдёҡдёӯж·ұе…ҘејҖеұ•д»ҘвҖңи®ІиҜҡдҝЎгҖҒе®Ҳ规иҢғгҖҒдҝғеҸ‘еұ•вҖқдёәе®—ж—Ёзҡ„иҜҡдҝЎе»әи®ҫзі»еҲ—жҙ»еҠЁгҖӮеңЁе…ЁеёӮиҚҜе“ҒгҖҒеҢ»з–—еҷЁжў°з”ҹдә§гҖҒз»ҸиҗҘдјҒдёҡдёӯејҖеұ•вҖңиҜҡдҝЎдјҒдёҡвҖқе»әи®ҫжҙ»еҠЁпјҢеҠӘеҠӣжҺЁиҝӣиҚҜе“ҒгҖҒеҢ»з–—еҷЁжў°дјҒдёҡдҝЎз”Ёзӯүзә§иҜ„е®ҡе·ҘдҪңгҖӮ继з»ӯжҠ“еҘҪйЈҹе“Ғе®үе…ЁдҝЎз”ЁдҪ“зі»е»әи®ҫзӨәиҢғеҚ•дҪҚиҜ„е®ҡе·ҘдҪң,жҸҗй«ҳдјҒдёҡдҫқжі•з»ҸиҗҘгҖҒиҜҡдҝЎз»ҸиҗҘж„ҸиҜҶгҖӮ
5гҖҒе…ЁйқўеҠ ејәжі•еҲ¶е®Јдј е’Ңж”ҝеҠЎдҝЎжҒҜе·ҘдҪңгҖӮзүўеӣәж ‘з«ӢвҖңе®Јдј е°ұжҳҜзӣ‘з®ЎвҖқгҖҒвҖңзҺҜеўғдҝғиҝӣеҸ‘еұ•вҖқзҡ„зҗҶеҝөпјҢзҙ§зҙ§еӣҙз»•йЈҹе“ҒиҚҜе“Ғзӣ‘з®Ўе·ҘдҪңзҡ„дёӯеҝғд»»еҠЎпјҢеҠ еӨ§еҠӣеәҰгҖҒжӢ“еұ•е№ҝеәҰгҖҒжҢ–жҺҳж·ұеәҰгҖҒдёҘе®Ҳе°әеәҰпјҢеҠӣдәүеңЁзңҒеұҖгҖҒеӣҪ家еұҖзҪ‘з«ҷгҖҒгҖҠдёӯеӣҪеҢ»иҚҜжҠҘгҖӢдёҠзҷ»иҪҪжӣҙеӨҡжңүд»ҪйҮҸзҡ„дҝЎжҒҜж–Үз« пјҢеҠӘеҠӣжү©еӨ§дҝЎжҒҜе·ҘдҪңзҡ„еҪұе“ҚеҠӣгҖӮе……еҲҶеҸ‘жҢҘеёӮеұҖеҸҠеҗ„еёӮеҢәеұҖзҪ‘з«ҷе’ҢйЈҹе“Ғе®үе…ЁзҪ‘зҪ‘з«ҷзҡ„дҪңз”ЁпјҢеҠ ејәзҪ‘з«ҷе»әи®ҫпјҢжү©еӨ§зҪ‘з«ҷеҪұе“ҚпјҢеҸҠж—¶еҸ‘еёғйў„иӯҰдҝЎжҒҜпјҢе…¬ејҖжӣқе…үеҲ¶е”®еҒҮеҶ’дјӘеҠЈйЈҹе“ҒиҚҜе“ҒиЎҢдёәпјҢдҪҝзҪ‘з«ҷжҲҗдёәе®Јдј жі•и§„гҖҒжҢҮеҜје®үе…ЁйҘ®йЈҹж¶Ҳиҙ№зҡ„зӘ—еҸЈгҖӮе№ҝжіӣејҖеұ•йЈҹе“ҒиҚҜе“Ғж”ҝзӯ–法规е’Ңе®үе…ЁзҹҘиҜҶиҝӣзӨҫеҢәгҖҒиҝӣеӯҰж ЎгҖҒиҝӣи¶…еёӮгҖҒиҝӣйӣҶеёӮгҖҒиҝӣеҶңжҲ·зҡ„вҖңдә”иҝӣвҖқжҙ»еҠЁпјҢеј•еҜје…¬дј—з§ҜжһҒеҸӮдёҺйЈҹе“ҒиҚҜе“Ғе®үе…Ёзҡ„зӨҫдјҡзӣ‘зқЈпјҢеӨҜе®һйЈҹе“ҒиҚҜе“Ғе®үе…Ёдҝқйҡңе·ҘдҪңзҡ„зӨҫдјҡеҹәзЎҖгҖӮ
дәҢгҖҒзӢ жҠ“еҚҸи°ғеҲӣе»әпјҢзқҖеҠӣжҸҗй«ҳйЈҹе“Ғе®үе…Ёз»јеҗҲзӣ‘з®ЎиғҪеҠӣ
1гҖҒеҒҘе…Ёе®Ңе–„йЈҹе“Ғе®үе…Ёз»јеҗҲеҚҸи°ғжңәеҲ¶гҖӮеҠ ејәйЈҹе“Ғе®үе…ЁиҙЈд»»дҪ“зі»гҖҒеҹәеұӮзӣ‘з®ЎзҪ‘з»ңдҪ“зі»гҖҒеә”жҖҘз®ЎзҗҶе’ҢжЎҲ件жҹҘеӨ„дҪ“зі»е»әи®ҫгҖӮеҜ№зҺ°жңүеҚҸи°ғжңәеҲ¶иҝӣиЎҢи°ғж•ҙе……е®һпјҢеҸҠж—¶з ”з©¶и§ЈеҶіеҗ„з§ҚйЈҹе“Ғе®үе…ЁйҮҚеӨ§й—®йўҳгҖӮ
2гҖҒж·ұе…ҘжҺЁиҝӣйЈҹе“Ғе®үе…ЁзӨәиҢғеҺҝгҖҒзӨәиҢғд№ЎпјҲй•ҮпјүеҲӣе»әжҙ»еҠЁгҖӮеҠ ејәеҜ№еҲӣе»әе·ҘдҪңзҡ„зқЈеҜјгҖҒжЈҖжҹҘдёҺиҖғж ёпјҢеҒҡеҘҪиҝҺжҺҘзңҒеұҖеҜ№зңҒзә§йЈҹе“Ғе®үе…ЁзӨәиҢғеҺҝзҡ„иҖғж ёиҜ„д»·пјҢз»„з»ҮејҖеұ•еҜ№еёӮзә§зӨәиҢғеҺҝзҡ„иҖғж ёиҜ„д»·е·ҘдҪңпјҢйҖӮж—¶еҗҜеҠЁз¬¬дәҢжү№зӨәиҢғеҺҝзҡ„еҲӣе»әе·ҘдҪңгҖӮеҗ„еёӮеҢәеұҖе№ҙеҶ…еҗҜеҠЁйЈҹе“Ғе®үе…ЁзӨәиҢғй•ҮеҲӣе»әе·ҘдҪңгҖӮ
3гҖҒжҠ“еҘҪйЈҹе“Ғе®үе…Ёдё“йЎ№ж•ҙжІ»е·ҘдҪңгҖӮеҮәеҸ°еёӮйЈҹе“Ғе®үе…Ёдё“йЎ№ж•ҙжІ»ж–№жЎҲпјҢиҒ”еҗҲзӣёе…ійғЁй—Ёжңүи®ЎеҲ’гҖҒзӘҒеҮәйҮҚзӮ№пјҢејҖеұ•еҜ№е»әзӯ‘е·Ҙең°йЈҹе ӮпјҢд»ҘеҸҠеӯҰж ЎйЈҹе Ӯд»ҘеҸҠеӯҰж Ўе‘Ёиҫ№е°ҸйӨҗйҘ®гҖҒе°Ҹе•Ҷеә—гҖҒе°ҸйЈҹжқӮеә—пјҢз§Ғеұ д№ұе®°д»ҘеҸҠиҠӮж—Ҙжңҹй—ҙзҡ„йЈҹе“Ғе®үе…Ёдё“йЎ№ж•ҙжІ»иЎҢеҠЁгҖӮ
4гҖҒеҠ ејәеҜ№йЈҹе“Ғе®үе…ЁйҮҚеӨ§дәӢж•…зҡ„йҳІиҢғгҖҒеӨ„зҪ®е’ҢзқЈжҹҘгҖӮе»әз«ӢеҒҘе…ЁжЎҲ件еҚҸжҹҘеҚҸдҪңжңәеҲ¶пјҢз§ҜжһҒејҖеұ•йЈҹе“Ғе®үе…ЁжҳҺжҹҘжҡ—и®ҝе’ҢйҮҚзӮ№е“Ғз§ҚжҠҪж ·жЈҖжөӢпјҢеҸҠ时收йӣҶйЈҹе“Ғе®үе…ЁдәӢ件жҲ–дәӢж•…дҝЎжҒҜпјҢдёҘж јжү§иЎҢгҖҠеёӮйЈҹе“Ғе®үе…ЁдәӢж•…пјҲжЎҲ件пјүзқЈеҜҹзқЈеҠһеҲ¶еәҰгҖӢпјҢиҗҪе®һйҮҚеӨ§йЈҹе“Ғе®үе…ЁдәӢж•…иҙЈд»»гҖӮ
дёүгҖҒе·©еӣәдё“йЎ№ж•ҙжІ»жҲҗжһңпјҢзқҖеҠӣжһ„е»әиҚҜе“Ғй•ҝж•Ҳзӣ‘з®Ў
1гҖҒејҖеұ•иҚҜе“Ғжү№еҮҶж–ҮеҸ·еҶҚжіЁеҶҢе·ҘдҪңгҖӮеҠ ејәзҺ°еңәж ёжҹҘе’Ңзӣ‘зқЈжЈҖжҹҘпјҢдёҘеҺүжҹҘеӨ„дёҚ规иҢғиЎҢдёәпјҢеқҡеҶіж·ҳжұ°дёҖжү№дёҚе…·еӨҮз”ҹдә§жқЎд»¶гҖҒиҙЁйҮҸж— дҝқиҜҒгҖҒе®үе…ЁйҡҗжӮЈиҫғеӨ§зҡ„е“Ғз§ҚгҖӮ
2гҖҒеҠ ејәеҢ–еӯҰеҺҹж–ҷиҚҜе’ҢеҢ»з–—жңәжһ„еҲ¶еүӮзӣ‘з®ЎгҖӮејҖеұ•еҢ–еӯҰеҺҹж–ҷиҚҜдё“йЎ№ж•ҙжІ»пјҢжЈҖдёҫжҹҘеӨ„иҝқ规з”ҹдә§гҖҒдҪҝз”ЁеҢ–еӯҰеҺҹж–ҷиҚҜзҡ„иЎҢдёәгҖӮеҜ№еӯҳеңЁе®үе…ЁйЈҺйҷ©зҡ„еҢ»з–—жңәжһ„еҲ¶еүӮиҝӣиЎҢйҮҚж–°е®ЎжҹҘе’ҢеҶҚжіЁеҶҢпјҢдҫқжі•жҹҘеӨ„иҝқжі•й…ҚеҲ¶гҖҒе®Јдј е’ҢдҪҝз”ЁеҢ»з–—жңәжһ„еҲ¶еүӮзҡ„иЎҢдёәпјҢзЎ®дҝқеҗҲжі•й…ҚеҲ¶зҡ„еҢ»з–—жңәжһ„еҲ¶еүӮе®үе…ЁеҸҜйқ пјҢиҙЁйҮҸеҸҜжҺ§гҖӮ
3гҖҒеҒҡеҘҪгҖҠиҚҜе“ҒжіЁеҶҢз®ЎзҗҶеҠһжі•гҖӢзҡ„е®ЈиҙҜе·ҘдҪңгҖӮеҠ ејәеҜ№иҚҜе“ҒжіЁеҶҢзҺ°еңәе’Ңиө„ж–ҷзңҹе®һжҖ§зҡ„ж ёжҹҘпјҢдҝқиҜҒз”іжҠҘиө„ж–ҷе’Ңж ·е“Ғзҡ„зңҹе®һжҖ§гҖҒ科еӯҰжҖ§гҖҒ规иҢғжҖ§гҖӮжҢүз…§зңҒеұҖзҡ„иҰҒжұӮпјҢејҖеұ•иҚҜе“ҒжіЁеҶҢз”ҹдә§зҺ°еңәжЈҖжҹҘе’ҢйҰ–жү№дә§е“ҒжҠҪйӘҢе·ҘдҪңгҖӮ
4гҖҒиҝӣдёҖжӯҘ规иҢғиҚҜе“Ғз”ҹдә§з§©еәҸгҖӮеӨ§еҠӣжҺЁиЎҢGMpз®ЎзҗҶеҲ¶еәҰпјҢдёҘж јж ҮеҮҶгҖҒе®Ңе–„зЁӢеәҸпјҢзЎ®дҝқи®ӨиҜҒиҙЁйҮҸпјӣеҠ еӨ§еҜ№е·ІйҖҡиҝҮи®ӨиҜҒдјҒдёҡзҡ„и·ҹиёӘжЈҖжҹҘе’ҢйЈһиЎҢжЈҖжҹҘеҠӣеәҰпјҢе·©еӣәGMpи®ӨиҜҒжҲҗжһңпјӣз§ҜжһҒжҺЁеҠЁдёӯиҚҜйҘ®зүҮдјҒдёҡжҸҗй«ҳе®һж–ҪGMpзҡ„йҖҹеәҰе’ҢиҙЁйҮҸпјӣеҒҡеҘҪжіЁе°„еүӮиҚҜе“Ғз”ҹдә§е·Ҙиүәе’ҢеӨ„ж–№ж ёжҹҘе·ҘдҪңпјӣиҝӣдёҖжӯҘе®Ңе–„й©»еҺӮзӣ‘зқЈе‘ҳдёҺиҚҜе“Ғз”ҹдә§еҠЁжҖҒзҪ‘з»ңзӣ‘з®Ўзӣёз»“еҗҲзҡ„зӣ‘з®ЎжңәеҲ¶пјҢе»әз«Ӣе®Ңе–„иҙЁйҮҸеҸ—жқғдәәеҲ¶еәҰпјӣиҝӣдёҖжӯҘ规иҢғи®ёеҸҜиҜҒзҡ„ж ёеҸ‘гҖҒеҸҳжӣҙиЎҢдёәгҖӮ
5гҖҒејәеҢ–зү№ж®ҠиҚҜе“Ғзӣ‘з®ЎгҖӮз»ҙжҠӨе’ҢеҸ‘жҢҘеҘҪзү№иҚҜзӣ‘жҺ§зҪ‘з»ңзҡ„дҪңз”ЁпјҢеҜ№зү№ж®ҠиҚҜе“ҒжөҒеҗ‘иҝӣиЎҢе®һж—¶зӣ‘жҺ§пјҢдёҘйҳІзү№ж®ҠиҚҜе“ҒжөҒејҠжЎҲ件еҸ‘з”ҹгҖӮејҖеұ•йә»й»„зўұеҺҹж–ҷиҚҜз»ҸиҗҘгҖҒдҪҝз”ЁзҺҜиҠӮдё“йЎ№жЈҖжҹҘгҖӮејҖеұ•е…ҙеҘӢеүӮдё“йЎ№ж•ҙжІ»пјҢеҜ№иӣӢзҷҪеҗҢеҢ–еҲ¶еүӮгҖҒиӮҪзұ»жҝҖзҙ з”ҹдә§з»ҸиҗҘжғ…еҶөиҝӣиЎҢеҪ»еә•жё…жҹҘпјҢж¶ҲйҷӨе®үе…ЁйҡҗжӮЈгҖӮ
6гҖҒиҝӣдёҖжӯҘ规иҢғиҚҜе“ҒжөҒйҖҡ秩еәҸгҖӮеҠ еӨ§GSpи®ӨиҜҒи·ҹиёӘжЈҖжҹҘеҠӣеәҰпјӣеҜ№иҚҜе“ҒиҗҘй”Җдәәе‘ҳе®һиЎҢзҷ»и®°еӨҮжЎҲз®ЎзҗҶпјӣеҠ ејәдә’иҒ”зҪ‘иҚҜе“ҒдәӨжҳ“жңҚеҠЎзӣ‘з®Ўпјӣи®Өзңҹз»„з»Үе®һж–ҪгҖҠзңҒиҚҜе“ҒдҪҝз”ЁжқЎдҫӢгҖӢе’ҢгҖҠзңҒиҚҜе“ҒдҪҝз”ЁиҙЁйҮҸз®ЎзҗҶ规иҢғгҖӢпјҢе®һж–ҪгҖҠиҚҜе“ҒдҪҝз”ЁиҙЁйҮҸз®ЎзҗҶ规иҢғзҺ°еңәжЈҖжҹҘиҜ„е®ҡж ҮеҮҶгҖӢпјҢеҲҮе®һ规иҢғеҢ»з–—жңәжһ„иҚҜе“ҒиҙЁйҮҸз®ЎзҗҶпјҢжҸҗй«ҳеҗҲзҗҶз”ЁиҚҜж°ҙе№ігҖӮ
7гҖҒеҠ ејәиҚҜе“ҒгҖҒеҢ»з–—еҷЁжў°е’ҢдҝқеҒҘйЈҹе“Ғе№ҝе‘Ҡзӣ‘жөӢгҖӮеҠ ејәж—Ҙеёёзӣ‘жөӢпјҢеҸҠ时移йҖҒиҝқжі•жғ…иҠӮдёҘйҮҚзҡ„е№ҝе‘ҠпјҢеҜ№жңүдёҘйҮҚиҝқжі•е№ҝе‘Ҡй—®йўҳзҡ„иҚҜе“ҒпјҢйҮҮеҸ–жҡӮеҒңй”Җе”®зҡ„иЎҢж”ҝејәеҲ¶жҺӘж–ҪгҖӮ
8гҖҒж·ұе…ҘејҖеұ•гҖҠиҚҜе“ҒеҸ¬еӣһз®ЎзҗҶеҠһжі•гҖӢгҖӮзқЈдҝғдјҒдёҡе»әз«ӢеҒҘе…ЁиҚҜе“ҒеҸ¬еӣһеҲ¶еәҰпјҢеҚҸеҠ©еҒҡеҘҪиҚҜе“ҒеҸ¬еӣһзҡ„жңүе…іе·ҘдҪңгҖӮ
9гҖҒеҠ еҝ«еҢ»з–—еҷЁжў°з”ҹдә§иҙЁйҮҸз®ЎзҗҶ规иҢғзҡ„зҡ„е®һж–Ҫе·ҘдҪңгҖӮеҠ еӨ§еҜ№дјҒдёҡжү§иЎҢеҢ»з–—еҷЁжў°з”ҹдә§иҙЁйҮҸз®ЎзҗҶ规иҢғзҡ„еҗ„项法规гҖҒж ҮеҮҶзҡ„зӣ‘зқЈжЈҖжҹҘеҠӣеәҰпјҢеҠ ејәеҜ№дәҢгҖҒдёүзұ»еҢ»з–—еҷЁжў°дә§е“ҒжіЁеҶҢжқҗж–ҷж ёжҹҘе·ҘдҪңгҖӮ
10гҖҒеҠ еӨ§еҜ№з»ҸиҗҘй«ҳйЈҺйҷ©еҢ»з–—еҷЁжў°дә§е“ҒдјҒдёҡзӣ‘з®ЎгҖӮиҝӣдёҖжӯҘеҠ ејәеҜ№й«ҳйЈҺйҷ©дә§е“Ғзӣ‘жҺ§пјҢе»әз«ӢдјҒдёҡиҙЁйҮҸдҫӢдјҡеҲ¶еәҰгҖӮеҜ№йҮҚзӮ№зӣ‘жҺ§дјҒдёҡиҙЁйҮҸдҫӢдјҡжҜҸеҚҠе№ҙеҸ¬ејҖдёҖж¬ЎпјҢдё»иҰҒеҶ…е®№жҳҜе®Јдј иҙҜеҪ»жңүе…іжі•еҫӢ法规пјҢйҖҡжҠҘж—Ҙеёёзӣ‘зқЈжЈҖжҹҘз»“жһңе’ҢдјҒдёҡдёҚиүҜиЎҢдёәзӯүгҖӮ
11гҖҒиҝӣдёҖжӯҘеҠ ејәеҢ»з–—еҷЁжў°дә§е“ҒиҙЁйҮҸзӣ‘зқЈжҠҪжҹҘгҖӮй’ҲеҜ№еёӮеңәзғӯзӮ№дә§е“Ғе’ҢдёҫжҠҘжҠ•иҜүеӨҡзҡ„е“Ғз§Қд»ҘеҸҠйҮҚзӮ№зӣ‘жҺ§дә§е“ҒпјҢејҖеұ•еҢ»з–—еҷЁжў°дә§е“ҒиҙЁйҮҸзӣ‘зқЈжҠҪжҹҘпјҢдҝғиҝӣдә§е“ҒиҙЁйҮҸдёҚж–ӯжҸҗй«ҳгҖӮ
12гҖҒзқҖеҠӣејәеҢ–иҚҜе“ҒзЁҪжҹҘе·ҘдҪңеҠӣеәҰгҖӮ继з»ӯејҖеұ•иҚҜе“Ғиҙӯй”ҖиЎҢдёәдё“йЎ№ж•ҙжІ»пјҢдёҘеҺүжҹҘеӨ„иҚҜе“ҒжҢӮйқ з»ҸиҗҘгҖҒи¶…иҢғеӣҙгҖҒи¶…ж–№ејҸз»ҸиҗҘгҖҒиө°з©әзҘЁгҖҒдҪ“еӨ–еҫӘзҺҜгҖҒеҮәз§ҹеҮәеҖҹгҖҠиҚҜе“Ғз»ҸиҗҘи®ёеҸҜиҜҒгҖӢзӯүиҝқжі•иҝқ规иЎҢдёәпјӣзӘҒеҮәйҮҚзӮ№пјҢиҝҪж №жәҜжәҗпјҢжҢӮзүҢзқЈеҠһпјҢеқҡеҶіжҹҘеӨ„иҝқжі•з»ҸиҗҘе’ҢеҲ¶е”®еҒҮеҠЈдәәз”ЁзӢӮзҠ¬з–«иӢ—гҖҒдәәиЎҖзҷҪиӣӢзҷҪгҖҒеҰҠеЁ иҚҜе“ҒзҠҜзҪӘиЎҢдёәпјӣеҠ еӨ§жҠҪйӘҢеҠӣеәҰпјҢеҠ ејәеҜ№е№ҝе‘ҠиҚҜе“Ғе’Ңи—ҸиҚҜгҖҒи’ҷиҚҜзҡ„зӣ‘з®ЎпјӣеўһеҠ жЈҖжҹҘйў‘ж¬ЎпјҢдёҘеҺүжҹҘеӨ„专科门иҜҠиҝқжі•дҪҝз”ЁиҮӘиЎҢй…ҚеҲ¶иҚҜе“Ғзҡ„иЎҢдёәпјӣйҮҮеҸ–жңүж•ҲжҺӘж–ҪпјҢеҠ ејәеҜ№йӮ®е”®иҚҜе“Ғе’ҢзҪ‘з»ңиҚҜе“ҒдәӨжҳ“зҡ„зӣ‘з®ЎпјӣеҠ еӨ§еҜ№еҢ»з–—еҷЁжў°з”ҹдә§гҖҒз»ҸиҗҘдјҒдёҡе’ҢдҪҝз”ЁеҚ•дҪҚзҡ„зӣ‘зқЈжү§жі•еҠӣеәҰе’Ңзӣ‘зқЈжЈҖжҹҘж¬Ўж•°пјҢйҮҚзӮ№жҹҘеӨ„ж— иҜҒз”ҹдә§з»ҸиҗҘеҢ»з–—еҷЁжў°пјҢз”ҹдә§з»ҸиҗҘдҪҝз”ЁдёҚеҗҲж јгҖҒжңӘз»ҸжіЁеҶҢзҡ„еҢ»з–—еҷЁжў°пјҢж“…иҮӘйҷҚдҪҺз”ҹдә§з»ҸиҗҘжқЎд»¶пјҢиҝӣиҙ§жё йҒ“дёҚ规иҢғгҖҒж“…иҮӘеҸҳжӣҙе®Ўжү№йЎ№зӯүиҝқжі•иЎҢдёәпјӣе»әз«ӢдёҺе…¬е®үзӯүзӣёе…ійғЁй—ЁиҒ”еҗҲеҠһжЎҲжңәеҲ¶пјҢжҠ“еҘҪеӨ§жЎҲиҰҒжЎҲзқЈжҹҘзқЈеҠһпјҢдҫқжі•жҹҘеӨ„иҝқжі•з”ҹдә§гҖҒй”Җе”®е’ҢдҪҝз”ЁеҒҮеҠЈиҚҜе“ҒиЎҢдёәгҖӮ
еӣӣгҖҒеҠ еҝ«дҝЎжҒҜеҢ–е»әи®ҫпјҢзқҖеҠӣеўһејәжҠҖжңҜж”Ҝж’‘иғҪеҠӣ
1гҖҒеҲ¶е®ҡе®һж–Ҫе…Ёзі»з»ҹдҝЎжҒҜеҢ–е»әи®ҫдёүе№ҙ规еҲ’гҖӮеҠӣдәүз”Ёдёүе№ҙе·ҰеҸізҡ„ж—¶й—ҙе»әжҲҗе…Ёзі»з»ҹдҝЎжҒҜеҢ–е·ҘдҪңе№іеҸ°пјҢеҲқжӯҘе®һзҺ°вҖңж•°еӯ—зӣ‘з®ЎвҖқгҖӮ
2гҖҒејҖйҖҡи§Ҷйў‘дјҡи®®е’ҢзҪ‘дёҠеҠһе…¬зі»з»ҹгҖӮжҢүз…§зңҒеұҖзҡ„з»ҹдёҖйғЁзҪІпјҢжҢүж—¶е®ҢжҲҗи§Ҷйў‘дјҡи®®зі»з»ҹзҡ„е®үиЈ…гҖҒи°ғиҜ•пјҢе°Ҫеҝ«дёҺзңҒеұҖеҜ№жҺҘпјҢзЎ®дҝқжҢүж—¶еҗҜз”ЁгҖӮз§ҜжһҒдёҺзңҒеұҖиҒ”зі»пјҢе№ҙеҶ…еңЁеёӮеұҖжңәе…іе’ҢжүҖеұһеҗ„еҚ•дҪҚејҖйҖҡOAеҠһе…¬зі»з»ҹпјҢеҠ ејәе…Ёе‘ҳеҹ№и®ӯпјҢе°Ҫеҝ«е®һзҺ°е…Ёзі»з»ҹзҪ‘дёҠж— зәёеҢ–еҠһе…¬гҖӮ
3гҖҒе»әи®ҫвҖңе…ЁеёӮиҚҜе“Ғе®һж—¶зӣ‘жҺ§зі»з»ҹвҖқгҖӮеҠ еҝ«е®Ўж ёи®әиҜҒе·ҘдҪңпјҢеҠ еӨ§иө„йҮ‘дәүеҸ–еҠӣеәҰпјҢз§ҜжһҒеҒҡеҘҪвҖңе…ЁеёӮиҚҜе“Ғе®һж—¶зӣ‘жҺ§зі»з»ҹвҖқзҡ„иҪҜ件ејҖеҸ‘гҖҒе®үиЈ…гҖҒи°ғиҜ•гҖҒеҹ№и®ӯдёҺеә”з”ЁпјҢеҠӣдәүе№ҙеҶ…еҗҜеҠЁиҝҗиЎҢпјҢе®һзҺ°еҜ№е…ЁеёӮж¶үиҚҜеҚ•дҪҚиҚҜе“ҒжқҘжәҗе’ҢжөҒеҗ‘зҡ„е®һж—¶зӣ‘жҺ§гҖӮ
4гҖҒз§ҜжһҒжҺўзҙўе»әз«Ӣ科еӯҰеҗҲзҗҶзҡ„иҚҜе“ҒжҠҪйӘҢжңәеҲ¶гҖӮеҠ ејәеҜ№еҶңжқ‘ең°еҢәиҚҜе“Ғз»ҸиҗҘгҖҒдҪҝз”ЁеҚ•дҪҚзҡ„зӣ‘з®ЎжҠҪйӘҢпјҢжү©еӨ§зӣ‘зқЈжҠҪйӘҢиҰҶзӣ–йқўпјҢжҸҗй«ҳдёҚеҗҲж јиҚҜе“ҒжЈҖеҮәзҺҮгҖӮеҠ ејәиҚҜе“ҒжЈҖйӘҢжЈҖжөӢж–№жі•з ”з©¶пјҢжҸҗй«ҳеҝ«жЈҖжҠҖжңҜеңЁзӣ‘з®Ўжү§жі•дёӯзҡ„дҪңз”ЁгҖӮиҝӣдёҖжӯҘеҠ ејәиҚҜе“ҒжЈҖйӘҢжңәжһ„еҹәзЎҖи®ҫж–Ҫе»әи®ҫпјҢеҠӘеҠӣж”№е–„е®һйӘҢе®ӨжқЎд»¶пјҢжү©еӨ§жЈҖйӘҢиҢғеӣҙпјҢжҸҗй«ҳжЈҖжөӢиғҪеҠӣе’Ңж°ҙе№іпјҢеҪўжҲҗеҸҚеә”еҝ«жҚ·гҖҒдёҠдёӢиҒ”еҠЁгҖҒеҠҹиғҪдјҳеҢ–гҖҒиҰҶзӣ–е…ЁеёӮзҡ„иҚҜе“ҒжЈҖйӘҢзҪ‘з»ңгҖӮ
5гҖҒејәеҢ–иҚҜе“ҒдёҚиүҜеҸҚеә”е’ҢеҢ»з–—еҷЁжў°дёҚиүҜдәӢ件зӣ‘жөӢгҖӮжү©еӨ§иҚҜе“ҒдёҚиүҜеҸҚеә”е’ҢеҢ»з–—еҷЁжў°дёҚиүҜдәӢ件жҠҘе‘ҠеҚ•дҪҚзҡ„иҢғеӣҙе’Ңж•°йҮҸпјҢжҸҗй«ҳж–°зҡ„гҖҒдёҘйҮҚзҡ„иҚҜе“ҒдёҚиүҜеҸҚеә”жҠҘе‘Ҡзҡ„жҜ”дҫӢпјҢйҷҚдҪҺжјҸжҠҘзҺҮпјҢеҠ ејәеҲҶжһҗиҜ„д»·пјҢжҸҗй«ҳйў„иӯҰе’Ңеә”жҖҘеӨ„зҪ®иғҪеҠӣгҖӮ
6гҖҒеҠ ејәеә”жҖҘз®ЎзҗҶгҖӮж·ұе…ҘиҙҜеҪ»гҖҠеӣҪеҠЎйҷўе…ідәҺеҠ ејәеҹәеұӮеә”жҖҘз®ЎзҗҶе·ҘдҪңзҡ„ж„Ҹи§ҒгҖӢпјҢиҝӣдёҖжӯҘеҒҘе…Ёеә”жҖҘз®ЎзҗҶеҲ¶еәҰгҖҒ规иҢғеә”жҖҘзЁӢеәҸгҖҒе®Ңе–„еә”жҖҘдҪ“зі»пјӣеҠ ејәеҚҸи°ғй…ҚеҗҲпјҢеҪўжҲҗеә”жҖҘеҝ«йҖҹеҸҚеә”иҒ”еҠЁжңәеҲ¶пјҢзЎ®дҝқйЈҹе“ҒгҖҒиҚҜе“ҒгҖҒеҢ»з–—еҷЁжў°е®үе…ЁдәӢ件早еҸ‘зҺ°пјҢжңүж•Ҳеә”еҜ№е’ҢеҸҠж—¶еӨ„зҪ®гҖӮеҗ„еёӮеҢәеұҖпјҲж–Үзҷ»еұҖйҷӨеӨ–пјүе№ҙеҶ…иҰҒз»„з»ҮејҖеұ•йҮҚеӨ§йЈҹе“ҒиҚҜе“Ғе®үе…ЁдәӢж•…еә”жҖҘжј”з»ғгҖӮ
дә”гҖҒеҠ ејәеҹәзЎҖе»әи®ҫпјҢзқҖеҠӣжҸҗй«ҳзӣ‘з®Ўдҝқйҡңж°ҙе№і
1гҖҒеҠ ејәе№ІйғЁдәәдәӢз®ЎзҗҶгҖӮеҒҡеҘҪдәӢдёҡеҚ•дҪҚдәәе‘ҳиҒҳз”ЁеҲ¶еәҰж”№йқ©зҡ„еҗҺз»ӯе·ҘдҪңпјӣе®ҢжҲҗдәәе‘ҳе®һеҗҚеҲ¶зҷ»и®°з®ЎзҗҶе·ҘдҪңпјӣи§ЈеҶіеҘҪе·Ҙиө„еҘ—ж”№д»ҘеҸҠжҙҘиҙҙгҖҒиЎҘиҙҙи°ғж•ҙеҗҺж¶үеҸҠеҲ°зҡ„е…·дҪ“й—®йўҳгҖӮгҖҗдёүжҳҜзӘҒеҮәйҮҚзӮ№,иҰҶзӣ–е…ЁйқўгҖӮз»“еҗҲе…·дҪ“еҢ»з–—еҷЁжў°жҠҪжЈҖе“Ғз§Қе’ҢжҲ‘иҫ–еҢәе®һйҷ…жғ…еҶө,гҖӮгҖ‘
2гҖҒжҸҗй«ҳжЎЈжЎҲз®ЎзҗҶж°ҙе№ігҖӮиҝӣдёҖжӯҘе®Ңе–„е’ҢиҗҪе®һе№ІйғЁдәәдәӢеҸҠиЎҢж”ҝжЎЈжЎҲзӯүеҹәзЎҖз®ЎзҗҶзҡ„еҹәзЎҖжҖ§е·ҘдҪңпјҢеҠӣдәүжЎЈжЎҲз®ЎзҗҶиҫҫеҲ°дёүзә§ж ҮеҮҶгҖӮ
3гҖҒеҠ еӨ§з»Ҹиҙ№дҝқйҡңеҠӣеәҰгҖӮй…ҚеҗҲзңҒеұҖеҒҡеҘҪи°ғжҹҘз ”з©¶е·ҘдҪңпјҢж·ұе…ҘеҲҶжһҗиҙўеҠЎиЈ…еӨҮдҝқйҡңе·ҘдҪңеӯҳеңЁзҡ„зӘҒеҮәзҹӣзӣҫе’Ңеӣ°йҡҫпјҢз§ҜжһҒжӢ“е®Ҫиө„йҮ‘жқҘжәҗпјҢдәүеҸ–еҗ„зә§иҙўж”ҝйғЁй—Ёзҡ„дё“йЎ№ж”ҜжҢҒгҖӮ
4гҖҒеҠ ејәиҙўеҠЎйў„з®—е’Ңиө„дә§з®ЎзҗҶгҖӮйҖҗжӯҘе»әз«Ӣе®Ңе–„йў„з®—зј–еҲ¶гҖҒжұҮжҖ»гҖҒе®Ўж ёе’ҢиҙўеҠЎеҲҶжһҗеҲ¶еәҰпјӣејәеҢ–иө„дә§з®ЎзҗҶпјҢ规иҢғиө„дә§зҡ„иҙӯзҪ®гҖҒеӨ„зҪ®иЎҢдёәпјӣз§ҜжһҒеҒҡеҘҪжү§жі•иЈ…еӨҮгҖҒеҠһе…¬и®ҫеӨҮгҖҒжЈҖйӘҢд»ӘеҷЁи®ҫеӨҮгҖҒдҝЎжҒҜеҢ–е»әи®ҫгҖҒжҲҝеұӢдҝ®зј®зӯүе·ҘдҪңпјҢдёҚж–ӯж”№е–„еҠһе…¬еҸҠжү§жі•жқЎд»¶гҖӮи®ӨзңҹеҒҡеҘҪе®Ўи®Ўе·ҘдҪңпјҢй…ҚеҗҲзңҒеұҖеҜ№дё“йЎ№иө„йҮ‘зҡ„дҪҝз”Ёжғ…еҶөйҮҚзӮ№иҝӣиЎҢе®Ўи®ЎпјҢ规иҢғиҙўеҠЎиЎҢдёәгҖӮ
5гҖҒи®ӨзңҹеҒҡеҘҪе®үе…ЁдҝқеҚ«е’ҢзӨҫдјҡжІ»е®үз»јеҗҲжІ»зҗҶе·ҘдҪңгҖӮеҠ ејәеҫ®жңәзҪ‘з»ңгҖҒеҠһе…¬и®ҫеӨҮгҖҒжңәе…іиҪҰиҫҶгҖҒзҺҜеўғеҚ«з”ҹзӯүеҗҺеӢӨз®ЎзҗҶпјҢдёәе№ІйғЁиҒҢе·ҘиҗҘйҖ е®үе…ЁгҖҒжё…жҙҒгҖҒйҖӮе®ңзҡ„еҠһе…¬зҺҜеўғе’Ңеҝ…иҰҒзҡ„еҠһе…¬жқЎд»¶гҖӮ
е…ӯгҖҒеҲҮе®һеҠ ејәйўҶеҜјзҸӯеӯҗе’Ңе№ІйғЁйҳҹдјҚе»әи®ҫпјҢзқҖеҠӣжү“йҖ дёҖжөҒзҡ„жү§жі•йҳҹдјҚ
1гҖҒи®ӨзңҹеӯҰд№ иҙҜеҪ»еҚҒдёғеӨ§зІҫзҘһгҖӮеқҡжҢҒеӯҰд»ҘиҮҙз”ЁгҖҒзҗҶи®әиҒ”зі»е®һйҷ…зҡ„еҺҹеҲҷпјҢиҝӣдёҖжӯҘеҠ ејәеҜ№е…ҡзҡ„еҚҒдёғеӨ§зІҫзҘһзҡ„еӯҰд№ иҙҜеҪ»пјҢеҠӘеҠӣз”ЁеҚҒдёғеӨ§зІҫзҘһжӯҰиЈ…е№ҝеӨ§е№ІйғЁиҒҢе·Ҙзҡ„еӨҙи„‘пјҢжҢҮеҜје®һи·өпјҢжҺЁеҠЁе·ҘдҪңгҖӮеҲҮе®һжҺЁиҝӣе·ҘдҪңжҢҮеҜјиҪ¬еҸҳпјҢдёҚж–ӯдё°еҜҢе®Ң善科еӯҰзӣ‘з®Ўзҡ„еҶ…ж¶өпјҢзқҖеҠӣеҠ ејәйЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎиғҪеҠӣе»әи®ҫпјҢжҸҗй«ҳжңҚеҠЎз»ҸжөҺзӨҫдјҡеҸ‘еұ•еӨ§еұҖзҡ„ж„ҸиҜҶе’Ңж°ҙе№ігҖӮ
2гҖҒеҠ ејәйўҶеҜјзҸӯеӯҗе’Ңе№ІйғЁйҳҹдјҚе»әи®ҫгҖӮе»әз«ӢеҒҘе…ЁдҪ“зҺ°з§‘еӯҰеҸ‘еұ•и§Ӯе’ҢжӯЈзЎ®ж”ҝз»©и§ӮиҰҒжұӮзҡ„е№ІйғЁиҖғж ёиҜ„д»·дҪ“зі»пјҢеҠ еӨ§е№ІйғЁдәӨжөҒеҠӣеәҰпјҢжӢ“е®Ҫе№ІйғЁе®һи·өй”»зӮјжё йҒ“пјҢеҠӘеҠӣжҸҗй«ҳзҸӯеӯҗй©ҫй©ӯе…ЁеұҖзҡ„иғҪеҠӣгҖҒз»јеҗҲеҚҸи°ғиғҪеҠӣпјҢеҠӘеҠӣжҸҗй«ҳзҸӯеӯҗзҡ„еҮқиҒҡеҠӣе’Ңеҗ‘еҝғеҠӣгҖӮ
3гҖҒеҠ еӨ§еҹ№и®ӯеҠӣеәҰгҖӮ继з»ӯејәеҢ–дёҡеҠЎеҹ№и®ӯпјҢеҲ¶и®ўе…ЁйқўгҖҒзі»з»ҹзҡ„ж•ҷиӮІеҹ№и®ӯи®ЎеҲ’пјҢз»„з»Үе№ҝеӨ§е№ІйғЁиҒҢе·Ҙи®ӨзңҹеӯҰд№ ж”ҝзӯ–法规пјҢејҖеұ•зҹҘиҜҶз«һиөӣгҖҒжҠҖжңҜжҜ”жӯҰе’Ңеҗ„йЎ№жҠҖиғҪи®ӯз»ғпјҢдёҚж–ӯжҸҗй«ҳиЎҢж”ҝжү§жі•иғҪеҠӣгҖӮеҸҠж—©е®үжҺ’йғЁзҪІпјҢз»„з»ҮејҖеұ•зЁҪжҹҘгҖҒжЈҖйӘҢжҠҖжңҜжҜ”жӯҰе’ҢеұӮеұӮйҖүжӢ”гҖҒеҹ№и®ӯе·ҘдҪңпјҢеҠӣдәүеңЁд»Ҡе№ҙе…ЁзңҒжҜ”жӯҰдёӯеҸ–еҫ—дјҳиүҜжҲҗз»©гҖӮ
4гҖҒзқҖеҠӣжҠ“еҘҪе…ҡйЈҺе»үж”ҝе»әи®ҫгҖӮи®ӨзңҹиҙҜеҪ»иҗҪе®һзңҒеұҖгҖҠе…ідәҺиҙҜеҪ»иҗҪе®һе»әз«ӢеҒҘе…Ёжғ©жІ»е’Ңйў„йҳІи…җиҙҘдҪ“зі»2016пјҚ2016е№ҙе·ҘдҪң规еҲ’зҡ„е®һж–ҪеҠһжі•гҖӢпјҢеңЁдёҘж јиҙҜеҪ»иҗҪе®һе…ҡйЈҺе»үж”ҝе»әи®ҫиҙЈд»»еҲ¶зҡ„еҹәзЎҖдёҠпјҢжіЁйҮҚжІ»жң¬пјҢжіЁйҮҚйў„йҳІпјҢжіЁйҮҚеҲ¶еәҰе»әи®ҫпјҢеқҡжҢҒдёҚжҮҲең°ејҖеұ•зӨҫдјҡдё»д№үж ёеҝғд»·еҖјдҪ“зі»ж•ҷиӮІгҖҒе…ҡйЈҺе»үж”ҝж•ҷиӮІе’ҢиҒҢдёҡйҒ“еҫ·ж•ҷиӮІгҖӮе№ҝжіӣејҖеұ•вҖңдёүи¶івҖқж•ҷиӮІпјҢж•ҷиӮІеј•еҜје№ІйғЁиҒҢе·ҘеңЁзү©иҙЁеҫ…йҒҮдёҠиҰҒзҹҘи¶іпјҢеңЁеӯҰд№ е’Ңе·ҘдҪңдёҠиҰҒзҹҘдёҚи¶іпјҢеңЁдәӢдёҡиҝҪжұӮдёҠиҰҒдёҚзҹҘи¶іпјҢеј•еҜјйј“еҠұе№ІйғЁиҒҢе·ҘдёҺж—¶дҝұиҝӣпјҢејҖжӢ“еҲӣж–°пјҢеҠӘеҠӣе№ІдёҖжөҒе·ҘдҪңпјҢеҲӣдёҖжөҒдёҡз»©гҖӮ
5гҖҒеҠӘеҠӣжҸҗй«ҳиЎҢж”ҝжү§жі•ж°ҙе№ігҖӮжҢүз…§е®һзҺ°вҖңдёүдёӘиҪ¬еҸҳвҖқзҡ„иҰҒжұӮпјҢз§ҜжһҒејҖеұ•иЎҢж”ҝ规иҢғеҢ–е»әи®ҫгҖӮеҮәеҸ°иҝӣдёҖжӯҘеҠ ејәжЎҲд»¶е®Ўж ёзҡ„ж„Ҹи§ҒпјҢеңЁе…Ёзі»з»ҹејҖеұ•жү§жі•жЎҲеҚ·иҜ„е®Ўжҙ»еҠЁпјҢдёҘж јжЎҲд»¶е®Ўж ёеҲ¶еәҰпјҢеҠ ејәдёҡеҠЎжҢҮеҜјпјҢиҝӣдёҖжӯҘжҸҗй«ҳжЎҲеҚ·иҙЁйҮҸгҖӮ
6гҖҒжҺЁиҝӣиЎҢйЈҺе’ҢзІҫзҘһж–ҮжҳҺе»әи®ҫеҗ‘жӣҙй«ҳж°ҙе№іеҸ‘еұ•гҖӮ继з»ӯж·ұеҢ–иЎҢж”ҝе®Ўжү№еҲ¶еәҰж”№йқ©пјҢеҠ ејәеҜ№иЎҢж”ҝе®Ўжү№иЎҢдёәзҡ„зӣ‘зқЈз®ЎзҗҶгҖӮеӨ§еҠӣжҺЁиЎҢж”ҝеҠЎе…¬ејҖпјҢд»Ҙж°‘дё»иҜ„и®®дёәиҪҪдҪ“пјҢеҠ ејәеҪўиұЎе®Јдј пјҢз§ҜжһҒеҒҡеҘҪиЎҢйЈҺзғӯзәҝдёҠзәҝе·ҘдҪңпјҢи®ӨзңҹеҠһзҗҶдәәеӨ§гҖҒж”ҝеҚҸжҸҗжЎҲгҖҒе»әи®®д»ҘеҸҠзҫӨдј—жҠ•иҜүгҖҒжқҘи®ҝе’ҢдёҫжҠҘдәӢйЎ№пјҢе»әз«Ӣе®Ңе–„дёҺиЎҢж”ҝзӣёеҜ№дәәзәҰи°ҲеҲ¶еәҰпјҢ继з»ӯе®һиЎҢж”ҝжү§жі•зӣ‘зқЈеҚЎгҖҒиЎҢж”ҝжү§жі•ж„Ҹи§ҒеҸҚйҰҲеҚЎеҲ¶еәҰпјҢдҪҝж”ҝйЈҺиЎҢйЈҺе»әи®ҫеҲ¶еәҰеҢ–гҖҒ规иҢғеҢ–гҖӮи®ӨзңҹиҙҜеҪ»иҗҪе®һгҖҠе…ЁзңҒйЈҹе“ҒиҚҜе“Ғзӣ‘з®Ўзі»з»ҹзІҫзҘһж–ҮжҳҺе»әи®ҫеҚҒдёҖдә”规еҲ’гҖӢпјҢе№ҝжіӣж·ұе…ҘејҖеұ•зІҫзҘһж–ҮжҳҺеҲӣе»әжҙ»еҠЁпјҢе·©еӣәеҲӣе»әжҲҗжһңпјҢз§ҜжһҒдәүеҸ–жӣҙеӨҡзҡ„еҚ•дҪҚжҲҗдёәзңҒзә§ж–ҮжҳҺеҚ•дҪҚе’Ңж–ҮжҳҺжңәе…іпјҢдёҚж–ӯжҠҠж–ҮжҳҺеҲӣе»әе·ҘдҪңеј•еҗ‘ж·ұе…ҘгҖӮ
第6зҜҮпјҲдёҖпјүд»ҘжҖқжғіе»әи®ҫдёәж №жң¬пјҢеңЁиҪ¬еҸҳи§ӮеҝөгҖҒејәеҢ–жңҚеҠЎдёҠе®һзҺ°еҲӣж–°гҖӮиҝӣдёҖжӯҘејәеҢ–еӣӣдёӘж„ҸиҜҶпјҡдёҖжҳҜејәеҢ–еӨ§еұҖж„ҸиҜҶгҖӮдәҢжҳҜејәеҢ–еҝ§жӮЈж„ҸиҜҶгҖӮдёүжҳҜејәеҢ–еҲӣж–°ж„ҸиҜҶгҖӮеӣӣжҳҜејәеҢ–е»үж”ҝж„ҸиҜҶгҖӮеңЁе·ҘдҪңдёҠиҰҒжӯЈзЎ®еӨ„зҗҶеҘҪвҖңдёүдёӘе…ізі»вҖқпјҡдёҖжҳҜеӨ„зҗҶеҘҪжһ„е»әе’Ңи°җзӨҫдјҡдёҺдёҘж јжү§жі•зҡ„е…ізі»гҖӮдәҢжҳҜеӨ„зҗҶеҘҪжҗһеҘҪжңҚеҠЎдёҺж ‘з«ӢйғЁй—ЁжқғеЁҒзҡ„е…ізі»гҖӮдёүжҳҜеӨ„зҗҶеҘҪе®ҢжҲҗе·ҘдҪңзӣ®ж Үе’ҢеҠ ејәе»үж”ҝе»әи®ҫзҡ„е…ізі»гҖӮ
пјҲдәҢпјүд»ҘйҳҹдјҚе»әи®ҫдёәж ёеҝғпјҢеңЁе®Ңе–„йҖүдәәз”ЁдәәжңәеҲ¶дёҠе®һзҺ°еҲӣж–°гҖӮдё»иҰҒеҒҡеҘҪдёүдёӘж–№йқўзҡ„е·ҘдҪңпјҡдёҖжҳҜеҠ ејәж•ҷиӮІеҹ№и®ӯгҖӮдәҢжҳҜж”№йқ©йҖүжӢ”д»»з”Ёж–№ејҸгҖӮдёүжҳҜеҠ еӨ§зӣ‘зқЈиҖғж ёеҠӣеәҰгҖӮ
пјҲдёүпјүд»Ҙ科жҠҖе»әи®ҫдёәе…ій”®пјҢеңЁзӣ‘з®ЎжүӢж®өдёҠе®һзҺ°еҲӣж–°гҖӮеҲӣж–°зӣ‘з®Ўж–№йқўзӘҒеҮәд»ҘдёӢйҮҚзӮ№пјҡдёҖжҳҜеҠ еҝ«е»әи®ҫе…ЁеёӮиҚҜе“Ғе®һж—¶з”өеӯҗзӣ‘жҺ§зі»з»ҹгҖӮдәҢжҳҜиҝӣдёҖжӯҘж·ұеҢ–еҜ№й«ҳйЈҺйҷ©иҚҜе“Ғз”ҹдә§дјҒдёҡзҡ„зӣ‘зқЈз®ЎзҗҶгҖӮдёүжҳҜе»әз«Ӣе®Ңе–„дё“йЎ№ж•ҙжІ»й•ҝж•ҲжңәеҲ¶гҖӮеӣӣжҳҜжӢ“е®ҪзЁҪжҹҘеҠһжЎҲжё йҒ“гҖӮдә”жҳҜзқҖеҠӣеҠ ејәиҚҜе“ҒгҖҒеҢ»з–—еҷЁжў°з”ҹдә§з»ҸиҗҘдјҒдёҡдёҚиүҜеҸҚеә”пјҲдёҚиүҜдәӢ件пјүзӣ‘жөӢе·ҘдҪңгҖӮ
пјҲеӣӣпјүд»ҘеҲ¶еәҰе»әи®ҫдёәеҹәзЎҖпјҢеңЁжҺЁиҝӣжү§жі•и§„иҢғеҢ–е’ҢдјҒдёҡиҜҡдҝЎиҮӘеҫӢдёҠе®һзҺ°еҲӣж–°гҖӮеңЁжү§жі•и§„иҢғеҢ–е»әи®ҫж–№йқўпјҢдёҖжҳҜиҰҒ规иҢғжү§жі•зЁӢеәҸгҖӮиҝӣдёҖжӯҘж ‘з«ӢзҺ°д»Јжү§жі•зҗҶеҝөпјҢеҜ№иЎҢж”ҝжү§жі•е·ҘдҪңе®һиЎҢжөҒзЁӢз®ЎзҗҶпјҢеҒҡеҲ°з«ӢжЎҲйҮҚдҫқжҚ®пјҢи°ғжҹҘйҮҚдәӢе®һпјҢе®Ўж ёйҮҚдҝқжҠӨпјҢеҶіе®ҡйҮҚеҗҲи®®пјҢжҠҠжҜҸдёӘжЎҲ件йғҪеҠһжҲҗдҝЎжЎҲгҖҒй“ҒжЎҲпјҢеўһејәиЎҢж”ҝжү§жі•зҡ„е…¬дҝЎеҠӣгҖӮдәҢжҳҜиҰҒ规иҢғжү§жі•иЎҢдёәгҖӮиҝӣдёҖжӯҘж ‘з«Ӣд»Ҙдәәдёәжң¬зҡ„зӣ‘з®ЎзҗҶеҝөпјҢз§ҜжһҒжҺЁиЎҢдәәжҖ§еҢ–жү§жі•жЁЎејҸпјҢеҒҡеҲ°и®Іж–ҮжҳҺгҖҒйҮҚзЁӢеәҸгҖҒйҮҚжҖҒеәҰпјҢеӨҡжңҚеҠЎпјҢеӨҡеё®дҝғпјҢе°‘еӨ„зҪҡпјҢеҜ№з®ЎзҗҶзӣёеҜ№дәәзҡ„иҝқжі•иЎҢдёәпјҢж №жҚ®дёҘйҮҚдёҺиҪ»еҫ®гҖҒиҝҮеӨұдёҺж•…ж„Ҹзӯүжғ…еҶөдәҲд»ҘеҢәеҲ«еҜ№еҫ…пјҢжҠҠжҹҘеӨ„е’Ңжү“еҮ»зҡ„йҮҚзӮ№ж”ҫеңЁеҲ¶е”®еҒҮеҠЈиҚҜе“ҒдёҠпјҢд»Ҙе®һйҷ…иЎҢеҠЁдҝғиҝӣе’Ңи°җжү§жі•гҖҒ科еӯҰзӣ‘з®ЎгҖӮдёүжҳҜиҰҒ规иҢғжү§жі•зӣ‘зқЈгҖӮдё»иҰҒжҳҜйҖҡиҝҮеӨҡз§Қжё йҒ“ж·ұеҢ–гҖҒз»ҶеҢ–еҶ…еӨ–еҸҢйҮҚзӣ‘зқЈгҖӮеңЁеҶ…йғЁзӣ‘зқЈж–№йқўпјҢиҰҒиҝӣдёҖжӯҘе®Ңе–„жі•еҲ¶йғЁй—Ёзӣ‘зқЈеҲ¶зәҰжңәеҲ¶пјҢдёҘжҠҠиҮӘз”ұиЈҒйҮҸжқғеҹәеҮҶпјҢжҺЁиЎҢиҜҙзҗҶејҸж–Үд№ҰеҲ¶дҪңпјҢжқңз»қе…ізі»жЎҲгҖҒдәәжғ…жЎҲе’ҢйҮ‘й’ұжЎҲгҖӮеңЁеӨ–йғЁзӣ‘зқЈж–№йқўпјҢйҖҡиҝҮж”ҝеҠЎдҝЎжҒҜе…¬ејҖгҖҒиҒҳиҜ·зӨҫдјҡд№үеҠЎзӣ‘зқЈе‘ҳгҖҒеҸ‘ж”ҫжү§жі•зӣ‘зқЈеҚЎгҖҒеҗ¬еҸ–дәәеӨ§е’Ңж”ҝеҚҸиҜ„и®®зӯүеӨҡз§ҚжҺӘж–ҪпјҢжҠҠжү§жі•иЎҢдёәзәіе…Ҙе…¬дј—зӣ‘зқЈд№ӢдёӢпјҢеўһејәжү§жі•зҡ„йҖҸжҳҺеәҰпјҢжңүж•Ҳең°и§ЈеҶіжү§жі•дёҚе…¬гҖҒжү§жі•дёҚдёҘгҖҒжү§жі•дёҚе»үзӯүй—®йўҳгҖӮ
пјҲдә”пјүд»ҘзҺҜеўғе»әи®ҫдёәдҫқжүҳпјҢеңЁжҗһеҘҪеҚҸи°ғжҢҮеҜјгҖҒдҝғиҝӣе’Ңи°җеҸ‘еұ•дёҠе®һзҺ°еҲӣж–°гҖӮиҰҒзқҖеҠӣи§ЈеҶіжҖқжғіи§ӮеҝөдёҠеӯҳеңЁзҡ„вҖңеҸӘе”Ҝжі•еҫӢгҖҒдёҚи®Іе®һйҷ…пјҢеҸӘйҳІеҮәй”ҷгҖҒдёҚжұӮеҲӣж–°пјҢеҸӘжұӮдҝқйҷ©гҖҒдёҚжӢ…йЈҺйҷ©вҖқзҡ„й—®йўҳпјҢиҝӣдёҖжӯҘејәеҢ–дё»еҠЁжңҚеҠЎеҸ‘еұ•зҡ„ж„ҸиҜҶпјҢеҠӘеҠӣеҒҡеҲ°вҖңеӣӣжҠ“еӣӣж»Ўж„ҸвҖқпјҡдёҖжҳҜжҠ“жңҚеҠЎгҖҒйҮҚ规иҢғгҖҒдҝғеҸ‘еұ•пјҢи®©дјҒдёҡж»Ўж„ҸгҖӮдё»иҰҒжҳҜеҠ ејәеҜ№ж–°иҚҜз ”еҸ‘зҡ„ж”ҝзӯ–жҢҮеҜје’ҢдҝЎжҒҜжңҚеҠЎпјҢз§ҜжһҒж”ҜжҢҒдјҒдёҡиҮӘдё»еҲӣж–°пјҢеҜ№дјҒдёҡз”іжҠҘзҡ„е…·жңүиҮӘдё»зҹҘиҜҶдә§жқғе’Ң科жҠҖеҗ«йҮҸй«ҳзҡ„еҗ„зұ»ж–°иҚҜгҖҒеҢ»з–—еҷЁжў°е’ҢдҝқеҒҘйЈҹе“ҒпјҢе®һиЎҢз»ҝиүІйҖҡйҒ“пјҢеҒҡеҲ°еҝ«е®ЎжҠҘпјҢеҝ«жү№еҠһпјҢз»ҷдәҲйҮҚзӮ№еҹ№жӨҚпјҢдјҳе…ҲеҸ‘еұ•гҖӮдәҢжҳҜжҠ“её®жү¶гҖҒйҖҒжё©жҡ–гҖҒи§Јж°‘еҝ§гҖҒи®©зҫӨдј—ж»Ўж„ҸгҖӮж·ұе…ҘжҺЁиҝӣеҶңжқ‘йЈҹе“ҒиҚҜе“Ғзӣ‘зқЈзҪ‘е’Ңдҫӣеә”зҪ‘е»әи®ҫпјҢд»ҘеҠ ејәеҺҝгҖҒй•ҮгҖҒжқ‘дё“е…јиҒҢиҚҜе“Ғзӣ‘з®Ўе‘ҳгҖҒеҚҸз®Ўе‘ҳгҖҒдҝЎжҒҜе‘ҳйҳҹдјҚе»әи®ҫдёәйҮҚзӮ№пјҢжҸҗй«ҳеҶңжқ‘йЈҹе“ҒиҚҜе“Ғзӣ‘з®Ўж°ҙе№іпјӣд»Ҙдҫҝж°‘жғ еҶңгҖҒзЎ®дҝқиҙЁйҮҸдёәйҮҚзӮ№пјҢеӨ§еҠӣеҸ‘еұ•еҶңжқ‘иҚҜе“Ғйӣ¶е”®зҪ‘зӮ№пјҢжҸҗй«ҳеҶңжқ‘иҚҜе“Ғдҫӣеә”зҪ‘иҝҗиЎҢиҙЁйҮҸгҖӮдёүжҳҜжҠ“ж•ҙжІ»гҖҒдёҘзӣ‘з®ЎгҖҒдҝқе®үе…ЁпјҢи®©ж”ҝеәңж»Ўж„ҸгҖӮзӘҒеҮәйҮҚзӮ№пјҢиҝҪж №жәҜжәҗпјҢжҢӮзүҢзқЈеҠһпјҢеқҡеҶіжҹҘеӨ„еҲ¶е”®еҒҮеҠЈиҚҜе“ҒзҠҜзҪӘиЎҢдёәгҖӮиҰҒеҠ ејәж—Ҙеёёзӣ‘жөӢпјҢеҸҠ时移йҖҒиҝқжі•иҚҜе“Ғе№ҝе‘ҠпјҢеҜ№жңүдёҘйҮҚиҝқжі•е№ҝе‘Ҡй—®йўҳзҡ„иҚҜе“ҒпјҢйҮҮеҸ–жҡӮеҒңй”Җе”®зҡ„иЎҢж”ҝејәеҲ¶жҺӘж–ҪпјҢеҲҮе®һз»ҙжҠӨзҫӨдј—еҲ©зӣҠпјҢзЎ®дҝқз”ЁиҚҜе®үе…ЁгҖӮеӣӣжҳҜжҠ“е®Ўжү№гҖҒи®Іж•ҲзҺҮгҖҒйҮҚе…¬ејҖпјҢи®©зӨҫдјҡж»Ўж„ҸгҖӮиҝӣдёҖжӯҘ规иҢғе®Ўжү№зЁӢеәҸпјҢжҺЁиҝӣе’Ңе®Ңе–„зҪ‘дёҠе®Ўжү№гҖҒе’ЁиҜўгҖҒеҸ—зҗҶгҖҒеҸҳжӣҙзӯүдәӢйЎ№гҖӮе®һиЎҢж”ҝеҠЎе…¬ејҖпјҢе»әз«ӢйҮҚиҰҒдҝЎжҒҜеҸ‘еёғеҲ¶еәҰпјҢе°ҶиЎҢж”ҝи®ёеҸҜдәӢйЎ№еҠһзҗҶзЁӢеәҸгҖҒи®ёеҸҜжқЎд»¶гҖҒж”ҝзӯ–ж ҮеҮҶгҖҒйҮҚеӨ§еҶізӯ–д»ҘеҸҠзӨҫдјҡеҗ„з•Ңжҷ®йҒҚе…іеҝғзҡ„зғӯзӮ№й—®йўҳеҸҠж—¶е…¬еёғпјҢдҪҝйғЁй—ЁиЎҢдёәе§Ӣз»ҲеӨ„дәҺзӨҫдјҡеҗ„з•Ңзҡ„зӣ‘зқЈд№ӢдёӢпјҢеҒҡеҲ°е…¬ејҖгҖҒе…¬жӯЈгҖҒдҫҝж°‘гҖҒй«ҳж•ҲгҖӮ
зҜҮдә”:дёүжҳҜзӘҒеҮәйҮҚзӮ№,иҰҶзӣ–е…ЁйқўгҖӮз»“еҗҲе…·дҪ“еҢ»з–—еҷЁжў°жҠҪжЈҖе“Ғз§Қе’ҢжҲ‘иҫ–еҢәе®һйҷ…жғ…еҶө,гҖӮ
2016йЈҹе“ҒиҚҜе“Ғе®үе…ЁжЈҖжҹҘе·ҘдҪңж–№жЎҲ3зҜҮ
第1зҜҮ
ж №жҚ®зңҒеёӮйЈҹе“ҒиҚҜе“Ғе®үе…ЁеӨ§жЈҖжҹҘе·ҘдҪңе®һж–Ҫж–№жЎҲзҡ„иҰҒжұӮпјҢз»“еҗҲжҲ‘еҺҝе®һйҷ…пјҢзү№еҲ¶е®ҡеҺҝйЈҹе“ҒиҚҜе“Ғе®үе…ЁеӨ§жЈҖжҹҘе·ҘдҪңе®һж–Ҫж–№жЎҲеҰӮдёӢпјҡ
дёҖгҖҒеҠ ејәйўҶеҜј
жҲҗз«ӢеҺҝйЈҹе“ҒиҚҜе“Ғе®үе…ЁеӨ§жЈҖжҹҘйўҶеҜје°Ҹз»„пјҢеұҖй•ҝд»»з»„й•ҝгҖҒеүҜеұҖй•ҝе’ҢжүҖй•ҝд»»еүҜз»„й•ҝгҖҒиҚҜе“Ғзӣ‘з®ЎиӮЎгҖҒзЁҪжҹҘиӮЎгҖҒйӨҗдҝқжүҖзӣёе…ідәәе‘ҳдёәжҲҗе‘ҳпјҢйўҶеҜје°Ҹз»„дёӢи®ҫеҠһе…¬е®ӨпјҢеҠһе…¬е®Өи®ҫеңЁжіЁе®ү科пјҢйҫҡзӯұе…°еҗҢеҝ—д»»еҠһе…¬е®Өдё»д»»гҖӮ
дәҢгҖҒеҠ еӨ§е®Јдј еҠӣеәҰ
7жңҲ15ж—ҘеҸ¬ејҖеҠЁе‘ҳеӨ§дјҡпјҢеҸӮдјҡдәәе‘ҳдёәе…ЁеұҖжүҖжңүе№ІйғЁиҒҢе·Ҙе’ҢжүҖжңүйЈҹе“ҒиҚҜе“Ғз”ҹдә§з»ҸиҗҘеҚ•дҪҚиҙҹиҙЈдәәпјҢи®ӨзңҹеӯҰд№ еёӮдәәж°‘ж”ҝеәңеҠһе…¬е®ӨгҖҠе…ідәҺиҝӣдёҖжӯҘеҠ ејәе®үе…Ёз”ҹдә§е·ҘдҪңзҡ„зҙ§жҖҘйҖҡзҹҘгҖӢгҖҒгҖҠе…ідәҺеҚ°еҸ‘е…ЁеёӮйҮҚзӮ№иЎҢдёҡйўҶеҹҹе®үе…Ёз”ҹдә§еӨ§жЈҖжҹҘе·ҘдҪңж–№жЎҲзҡ„йҖҡзҹҘгҖӢд»ҘеҸҠзңҒеұҖгҖҠе…ідәҺйӣҶдёӯејҖеұ•е®үе…Ёз”ҹдә§еӨ§жЈҖжҹҘзҡ„зҙ§жҖҘйҖҡзҹҘгҖӢгҖҒгҖҠе…ідәҺеҚ°еҸ‘е…ЁзңҒйЈҹе“ҒиҚҜе“Ғе®үе…ЁеӨ§жЈҖжҹҘе·ҘдҪңе®һж–Ҫж–№жЎҲзҡ„йҖҡзҹҘгҖӢпјҲиөЈйЈҹиҚҜзӣ‘еҠһгҖ”2016гҖ•32еҸ·пјүгҖҒе…ідәҺгҖҠеҚ°еҸ‘е…ЁеёӮйЈҹе“ҒиҚҜе“Ғе®үе…ЁеӨ§жЈҖжҹҘе·ҘдҪңе®һж–Ҫж–№жЎҲзҡ„йҖҡзҹҘгҖӢпјҢйғЁзҪІе…ЁеҺҝйЈҹе“ҒиҚҜе“Ғе®үе…ЁеӨ§жЈҖжҹҘе·ҘдҪңгҖӮ
дёүгҖҒжЈҖжҹҘеҶ…е®№е’Ңж—¶й—ҙе®үжҺ’
1гҖҒж—¶й—ҙе®үжҺ’пјҡ
2016е№ҙ7жңҲ15ж—Ҙ-8жңҲ15ж—ҘдёәиҮӘжҹҘйҳ¶ж®өпјҢжүҖжңүйЈҹе“ҒиҚҜе“ҒпјҲеҷЁжў°пјҢдёӢеҗҢпјүз”ҹдә§з»ҸиҗҘеҚ•дҪҚз»„з»ҮејҖеұ•йЈҹе“ҒиҚҜе“Ғе®үе…ЁиҮӘжҹҘпјҢж·ұе…ҘеҪ»еә•жҺ’жҹҘжІ»зҗҶйЈҹе“ҒиҚҜе“Ғе®үе…ЁйҡҗжӮЈпјҢжҺ’жҹҘжғ…еҶөгҖҒж•ҙж”№ж–№жЎҲе’Ңж•ҙж”№з»“жһңдәҺ8жңҲ12ж—ҘеүҚдёҠжҠҘеҺҝйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖеӨҮжЎҲгҖӮ
2016е№ҙ8жңҲ16ж—Ҙ-9жңҲ15ж—ҘдёәжЈҖжҹҘйҳ¶ж®өпјҢеҺҝйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖеҜ№жң¬иҫ–еҢәзҡ„йЈҹе“ҒиҚҜе“Ғз”ҹдә§з»ҸиҗҘеҚ•дҪҚиҝӣиЎҢе…Ёйқўзҡ„зҺ°еңәе®үе…ЁжЈҖжҹҘпјҢеҜ№жң¬йғЁй—Ёзҡ„е®үе…Ёжғ…еҶөиҝӣиЎҢйҡҗжӮЈжҺ’жҹҘпјҢеҜ№жЈҖжҹҘгҖҒжҺ’жҹҘеҮәзҡ„е®үе…ЁйҡҗжӮЈеҝ…йЎ»еҒҡеҲ°йҖҗжқЎж•ҙж”№гҖҒйҖҗйЎ№иҗҪе®һгҖҒдёҚз•ҷеҗҺжӮЈгҖӮ
2016е№ҙ9жңҲ16ж—Ҙ-30ж—ҘпјҢеёӮеұҖз»„з»ҮеҜ№йғЁеҲҶеҺҝпјҲеёӮгҖҒеҢәпјүејҖеұ•йЈҹе“ҒиҚҜе“Ғе®үе…ЁеӨ§жЈҖжҹҘжғ…еҶөиҝӣиЎҢжҠҪжҹҘпјҢеҜ№еҸ‘зҺ°зҡ„й—®йўҳиҝӣиЎҢйҖҡжҠҘгҖӮ
2гҖҒжЈҖжҹҘеҶ…е®№пјҡ
йЈҹе“Ғе®үе…ЁйўҶеҹҹпјҡдёҖжҳҜејҖеұ•йҮҚзӮ№йўҶеҹҹгҖҒйҮҚзӮ№е“Ғз§Қзҡ„зӣ‘зқЈжЈҖжҹҘгҖӮзү№еҲ«иҰҒеҠ ејәйӨҗйҘ®зҺҜиҠӮгҖҒеӯҰж ЎйЈҹе ӮгҖҒж°‘е·ҘйЈҹе ӮгҖҒжңәе…ійЈҹе ӮгҖҒдјҒдёҡйЈҹе Ӯд»ҘеҸҠеҶңжқ‘иҒҡйӨҗзҡ„йЈҹе“Ғе®үе…Ёзӣ‘жҺ§е·ҘдҪңпјҢеҠ еӨ§еҜ№зҶҹиӮүеҲ¶е“ҒгҖҒеҚӨеҲ¶е“ҒгҖҒж°ҙдә§е“Ғд»ҘеҸҠйҮҮйЈҹйҮҺз”ҹиҳ‘иҸҮзҡ„зӣ‘з®ЎеҠӣеәҰгҖӮдәҢжҳҜжҠ“еҘҪжү“еҮ»вҖңдҝқеҒҘйЈҹе“ҒвҖқеӣӣйқһдё“йЎ№иЎҢеҠЁпјҢдёҘеҺүжү“еҮ»дҝқеҒҘйЈҹе“Ғйқһжі•ж·»еҠ гҖҒйқһжі•з”ҹдә§гҖҒйқһжі•з»ҸиҗҘгҖҒйқһжі•е®Јдј зӯүдёҚжі•иЎҢдёәпјҢйҮҚзӮ№жЈҖжҹҘжҳ“еҸ‘з”ҹиҝқжі•ж·»еҠ иЎҢдёәзҡ„еҮҸиӮҘгҖҒиҫ…еҠ©йҷҚиЎҖзі–гҖҒзј“и§ЈдҪ“еҠӣз–ІеҠігҖҒж”№е–„зқЎзң зӯүдә§е“ҒдјҒдёҡпјҢжҹҘе өеҸҜиғҪеҸ‘з”ҹй—®йўҳзҡ„е®үе…ЁжјҸжҙһпјҢжӯӨйЎ№е·ҘдҪңз”ұеҺҝйӨҗдҝқжүҖиҙҹиҙЈгҖӮ
еҢ»з–—еҷЁжў°е®үе…ЁйўҶеҹҹпјҡйҮҚзӮ№жЈҖжҹҘдёҖж¬ЎжҖ§дҪҝз”Ёж— иҸҢеҢ»з–—еҷЁжў°зү№еҲ«жҳҜиҫ“жіЁеҷЁе…·гҖҒйә»йҶүз©ҝеҲәеҢ…зӯүзӣҙжҺҘдёҺдәәдҪ“иЎҖж¶ІеҫӘзҺҜзӣёжҺҘи§Ұзҡ„еҢ»з–—еҷЁжў°пјҢзӘҒеҮәжЈҖжҹҘеҺҹжқҗж–ҷйҮҮиҙӯгҖҒеҺҹжқҗж–ҷжЈҖйӘҢжҲ–йӘҢиҜҒгҖҒз”ҹдә§иҝҮзЁӢпјҲе…ій”®жҺ§еҲ¶зӮ№пјүжЈҖйӘҢгҖҒеҮәеҺӮжЈҖйӘҢгҖҒдёҚеҗҲж је“ҒжҺ§еҲ¶зӯүе…ій”®зҺҜиҠӮпјҢз”ҹдә§гҖҒжЈҖйӘҢгҖҒзҺҜж°§д№ҷзғ·ж¶ҲжҜ’гҖҒи®ҫеӨҮжҳҜеҗҰе®ҢеҘҪгҖӮеҠ еӨ§еҜ№йӘЁз§‘жӨҚе…Ҙзү©гҖҒеҝғи„Ҹиө·жҗҸеҷЁгҖҒиЎҖз®ЎеҶ…еҜјз®ЎгҖҒж”Ҝжһ¶гҖҒд»Ӣе…ҘеҷЁжқҗгҖҒдәәе·Ҙжҷ¶дҪ“гҖҒдәәе·Ҙеҝғи„Ҹз“ЈиҶңзӯүй«ҳйЈҺйҷ©дә§е“Ғзӣёе…із»ҸиҗҘе’ҢдҪҝз”ЁеҚ•дҪҚзҡ„зӣ‘зқЈжЈҖжҹҘгҖӮ
иҚҜе“Ғе®үе…ЁйўҶеҹҹпјҡиҰҒд»ҺиҙЁйҮҸжҺ§еҲ¶гҖҒзү©ж–ҷз®ЎзҗҶгҖҒз”ҹдә§з®ЎзҗҶзӯүзҺҜиҠӮпјҢи®ӨзңҹжҹҘжүҫеҸҜиғҪеӯҳеңЁзҡ„иҚҜе“Ғе®үе…ЁйҡҗжӮЈпјҢзӣ‘зқЈдјҒдёҡдёҘж јжү§иЎҢиҚҜе“ҒGMpзҡ„жңү关规е®ҡпјҢзӣ‘зқЈдјҒдёҡдёҘж јжҢүз…§жіЁеҶҢзҡ„ж ҮеҮҶз»„з»Үз”ҹдә§е’ҢжЈҖйӘҢгҖӮиҰҒиҝӣдёҖжӯҘеҠ еӨ§з»ҸиҗҘйә»йҶүиҚҜе“ҒгҖҒзІҫзҘһиҚҜе“ҒгҖҒеҢ»з–—з”ЁжҜ’жҖ§иҚҜе“ҒгҖҒжҳ“еҲ¶жҜ’еҢ–еӯҰеҲ¶еүӮгҖҒе…ҙеҘӢеүӮгҖҒз”ҹзү©еҲ¶еүӮгҖҒиЎҖж¶ІеҲ¶е“ҒгҖҒз–«иӢ—гҖҒеҹәжң¬иҚҜзү©зӯүйҮҚзӮ№е“Ғз§Қзҡ„дјҒдёҡзҡ„зӣ‘зқЈжЈҖжҹҘпјҢзӣ‘зқЈдјҒдёҡдёҘж јжү§иЎҢиҚҜе“ҒGSpзҡ„жңү关规е®ҡгҖӮ
е®үе…Ёз”ҹдә§йўҶеҹҹпјҡиҰҒзқЈдҝғиҫ–еҢәеҶ…жүҖжңүж¶үиҚҜж¶үжў°еҚ•дҪҚе’ҢйЈҹе“ҒиҚҜе“ҒжЈҖйӘҢжүҖејҖеұ•е…ЁйқўиҮӘжҹҘе·ҘдҪң,зқЈдҝғе…¶еҠ ејәеҚұйҷ©еҢ–еӯҰе“ҒдҪҝз”Ёи®ҫж–ҪгҖҒи®ҫеӨҮгҖҒе®үе…Ёйҷ„件зҡ„е®үе…ЁжЈҖжҹҘпјҢеҠ ејәеҜ№й«ҳжё©гҖҒй«ҳеҺӢгҖҒжҳ“зҮғгҖҒжҳ“зҲҶзӯүйҮҚзӮ№иҪҰй—ҙгҖҒйҮҚзӮ№йғЁдҪҚзҡ„е®үе…Ёзӣ‘жҺ§пјҢеҸҠжі„йңІзӣ‘жөӢжҠҘиӯҰгҖҒйҖҡйЈҺгҖҒйҳІзҒ«йҳІзҲҶи®ҫж–Ҫи®ҫзҪ®з»ҙжҠӨеҸҠиҝҗиЎҢзҡ„жЈҖжҹҘ,еҠ ејәйә»йҶүиҚҜе“ҒгҖҒзІҫзҘһиҚҜе“ҒгҖҒжҜ’жҖ§иҚҜжқҗ(иҚҜе“Ғ)гҖҒиҸҢжҜ’з§ҚгҖҒзҺҜж°§д№ҷзғ·зҒӯиҸҢж°”дҪ“е’ҢеҚұйҷ©еҢ–еӯҰе“Ғзҡ„з®ЎзҗҶгҖӮ
еӣӣгҖҒжңүе…іиҰҒжұӮ
1гҖҒеҠ еӨ§е®Јдј жҠҘйҒ“гҖӮиҰҒз»“еҗҲвҖңе®үе…Ёз”ҹдә§жңҲвҖқжҙ»еҠЁпјҢе……еҲҶеҲ©з”ЁжҠҘзәёгҖҒе№ҝж’ӯгҖҒз”өи§ҶгҖҒзҪ‘з»ңзӯүеҗ„з§ҚеӘ’дҪ“пјҢйҮҮеҸ–еӨҡз§ҚеҪўејҸпјҢе№ҝжіӣејҖеұ•йЈҹе“ҒиҚҜе“Ғе®ү全法规гҖҒеҲ¶еәҰе’ҢзҹҘиҜҶзӯүзі»еҲ—е®ЈиҙҜжҙ»еҠЁгҖӮиҰҒе№ҝжіӣеҸ‘еҠЁзҫӨдј—пјҢи®ҫз«ӢдёҫжҠҘз”өиҜқгҖҒдҝЎз®ұпјҢе…¬еёғдёҫжҠҘеҘ–еҠұеҠһжі•пјҢйј“еҠұзӨҫдјҡдёҫжҠҘ并еҸҠж—¶е…‘зҺ°еҘ–еҠұгҖӮ
2гҖҒиҗҪе®һж•ҙж”№жҺӘж–ҪгҖӮеҜ№жЈҖжҹҘеҮәжқҘзҡ„йЈҹе“ҒиҚҜе“Ғе®үе…Ёй—®йўҳе’ҢйҡҗжӮЈйғҪиҰҒеҲ—еҮәжё…еҚ•пјҢе»әз«ӢеҸ°иҙҰпјҢж ҮжҳҺжЈҖжҹҘж—¶й—ҙгҖҒжЈҖжҹҘдәәе‘ҳпјҢиў«жЈҖжҹҘеҚ•дҪҚеҗҚз§°гҖҒеҸ‘зҺ°й—®йўҳе’ҢйҡҗжӮЈпјҢ并жҸҗеҮәж•ҙж”№иҰҒжұӮпјӣиҰҒдјҡеҗҢжүҖеңЁеҚ•дҪҚе•Ҷе®ҡж•ҙж”№дәӢйЎ№пјҢжҳҺзЎ®ж•ҙж”№жҺӘж–ҪгҖҒиө„йҮ‘гҖҒиҙЈд»»гҖҒж—¶йҷҗе’Ңйў„жЎҲзӯүдәӢйЎ№пјҢеҒҡеҲ°вҖңдә”иҗҪе®һвҖқпјӣеҜ№еҸҜиғҪеј•еҸ‘иҫғеӨ§гҖҒйҮҚеӨ§йЈҹе“ҒиҚҜе“Ғе®үе…ЁдәӢж•…йҡҗжӮЈпјҢз«ӢеҚідёӢиҫҫж•ҙж”№йҖҡзҹҘпјҢ并е°Ҷжңүе…ідҝЎжҒҜиҰҒеҸҠж—¶жҠҘе‘ҠеҺҝж”ҝеәңе’ҢеёӮеұҖйЈҹе“ҒиҚҜе“Ғе®үе…ЁеӨ§жЈҖжҹҘйўҶеҜје°Ҹз»„еҠһе…¬е®ӨгҖӮ
3гҖҒе»әз«Ӣй•ҝж•ҲжңәеҲ¶гҖӮиҝӣдёҖжӯҘе®Ңе–„йҡҗжӮЈжҺ’жҹҘж•ҙжІ»е·ҘдҪңжңәеҲ¶пјҢе»әз«Ӣз»ҶеҢ–еҲ°жҜҸдёӘеІ—дҪҚзҡ„ж—ҘеёёйҡҗжӮЈжҺ’жҹҘж•ҙж”№еҲ¶еәҰпјҢе®ҡжңҹеҗ‘еҺҝж”ҝеәңе’ҢдёҠзә§йЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎйғЁй—ЁжҠҘеӨҮйҡҗжӮЈжҺ’жҹҘжғ…еҶөгҖҒж•ҙж”№з»“жһңгҖӮеҸҠж—¶жҖ»з»“з»ҸйӘҢпјҢеҲ¶е®ҡи§„з« еҲ¶еәҰе’Ңж ҮеҮҶ规иҢғпјҢдҝғиҝӣйҡҗжӮЈжҺ’жҹҘжІ»зҗҶеҲ¶еәҰеҢ–гҖҒ规иҢғеҢ–гҖҒеёёжҖҒеҢ–гҖӮ
4гҖҒдёҘж јйҒөе®ҲжҺ’жҹҘе·ҘдҪңзәӘеҫӢгҖӮиҰҒйҖҡиҝҮдёҖеҗ¬гҖҒдәҢзңӢгҖҒдёүжҹҘгҖҒеӣӣдҝғзҡ„ж–№ејҸпјҢж·ұе…Ҙе®һйҷ…гҖҒж·ұе…ҘзҺ°еңәгҖҒж·ұе…ҘеҹәеұӮгҖҒж·ұе…ҘдјҒдёҡпјҢдёҘиӮғи®Өзңҹең°ејҖеұ•йЈҹе“ҒиҚҜе“Ғе®үе…ЁеӨ§жЈҖжҹҘжҙ»еҠЁгҖӮдёҘж јжү§иЎҢдёӯеӨ®вҖң八项规е®ҡвҖқе’ҢзңҒ委зңҒж”ҝеәңжңү关规е®ҡпјҢиҪ»иҪҰз®Җд»ҺпјҢе»үжҙҒжү§жі•гҖҒеӢӨдҝӯиҠӮзәҰгҖӮеҜ№еҸ‘зҺ°зҡ„е®үе…ЁйҡҗжӮЈе’Ңй—®йўҳпјҢиҰҒж•ўдәҺеҠЁзңҹгҖҒж•ўдәҺзў°зЎ¬пјҢеҒҡеҲ°жЈҖжҹҘдёҚз•ҷжӯ»и§’гҖҒж•ҙжІ»дёҚз•ҷеҗҺжӮЈгҖӮ
第2зҜҮдёҖгҖҒжҢҮеҜјжҖқжғі
д»Ҙе…ҡзҡ„еҚҒе…«еӨ§зІҫзҘһдёәжҢҮеҜјпјҢж·ұе…ҘиҙҜеҪ»иҗҪе®һ科еӯҰеҸ‘еұ•и§ӮпјҢеқҡжҢҒе…ҡзҡ„зҫӨдј—и·Ҝзәҝж–№й’ҲпјҢеӨ§еҠӣжҺЁиЎҢиЎҢж”ҝжқғеҠӣе…¬ејҖйҖҸжҳҺиҝҗиЎҢпјҢе®һзҺ°е…¬ејҖжүҝиҜәпјҢжҺҘеҸ—зӨҫдјҡзӣ‘зқЈпјҢе®Ңе–„е·ҘдҪңжөҒзЁӢпјҢзј©зҹӯе·ҘдҪңж—¶йҷҗпјҢжҸҗй«ҳжңҚеҠЎиҙЁйҮҸпјҢиҝӣдёҖжӯҘж”№иҝӣе·ҘдҪңдҪңйЈҺпјҢжҸҗеҚҮжңәе…іж•ҲиғҪпјҢеҠӘеҠӣе»әи®ҫиЎҢдёә规иҢғгҖҒиҝҗиҪ¬еҚҸи°ғгҖҒе…¬жӯЈйҖҸжҳҺгҖҒе»үжҙҒй«ҳж•ҲгҖҒжңҚеҠЎең°ж–№еҸ‘еұ•зҡ„йЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎдәӢдёҡж–°еҪўиұЎгҖӮ
дәҢгҖҒжҖ»дҪ“зӣ®ж Ү
жңҚеҠЎиҙЁйҮҸжҳҺжҳҫжҸҗеҚҮгҖӮжҺЁеҮәе®һе®һеңЁеңЁзҡ„дҫҝж°‘жҺӘж–ҪпјҢдёәзҫӨдј—жҸҗдҫӣй•ҝж•Ҳй«ҳиҙЁйҮҸзҡ„жңҚеҠЎгҖӮжңәе…іе·ҘдҪңдәәе‘ҳзҡ„жңҚеҠЎж„ҸиҜҶгҖҒеӨ§еұҖж„ҸиҜҶгҖҒеҸ‘еұ•ж„ҸиҜҶгҖҒиҙЈд»»ж„ҸиҜҶжҳҺжҳҫеўһејәпјҢи®©зҫӨдј—ж·ұж„ҹжңәе…ідҪңйЈҺе»әи®ҫзҡ„ж–°еҸҳеҢ–гҖҒж–°зӘҒз ҙгҖӮ
еҠһдәӢж•ҲзҺҮжҳҺжҳҫжҸҗй«ҳгҖӮеҠһдәӢзЁӢеәҸгҖҒеҠһдәӢж ҮеҮҶгҖҒеҠһдәӢз»“жһңеҫ—д»ҘеҲ¶еәҰеҢ–дҪ“зҺ°гҖҒеёёжҖҒеҢ–еӣәе®ҡгҖҒж—ҘеёёеҢ–ејҖеұ•гҖҒ规иҢғеҢ–иҝҗиЎҢпјҢд»Ҙе…·дҪ“еҠһдәӢзҺҜиҠӮгҖҒжңҚеҠЎжҺӘж–ҪдёәзӘҒз ҙеҸЈпјҢеҲҮе®һжҸҗй«ҳеҠһдәӢж•ҲзҺҮгҖӮ
еҸ‘еұ•зҺҜеўғжҳҺжҳҫдјҳеҢ–гҖӮж ‘з«ӢвҖңзӣ‘з®ЎдҝғеҸ‘еұ•вҖқзҡ„зҗҶеҝөпјҢеқҡжҢҒдёәж°‘жңҚеҠЎгҖҒдёәж°‘и§Јеҝ§пјҢжү“йҖ е»үжҙҒеҠЎе®һй«ҳж•Ҳзҡ„ж”ҝеҠЎзҺҜеўғгҖҒе…¬жӯЈдёҘжҳҺзҡ„жі•еҲ¶зҺҜеўғгҖҒе’Ңи°җзЁіе®ҡзҡ„иҲҶи®әдёҺзӨҫдјҡзҺҜеўғпјҢдҪҝиҚҜзӣ‘йғЁй—ЁзңҹжӯЈжҲҗдёәдёҖжөҒзҡ„зӣ‘з®Ўжңәе…ігҖҒдёҖжөҒзҡ„жңҚеҠЎжңәе…іпјҢдёәжҲ‘еҺҝе®һзҺ°вҖңдёүе№ҙе…ЁеёӮжҺ’еӨҙе…өпјҢдә”е№ҙе…ЁзңҒеұ…дёҠжёёвҖқзӣ®ж Үдё»еҠЁжңҚеҠЎгҖҒз§ҜжһҒдҪңдёәгҖӮ
дёүгҖҒжҙ»еҠЁеҶ…е®№
пјҲдёҖпјүе»әз«ӢжҠ•иҜүжңәеҲ¶пјҢеҸҠж—¶еҠһзҗҶеӣһеӨҚгҖӮиҝӣдёҖжӯҘе®Ңе–„йҰ–й—®иҙЈд»»еҲ¶пјҢеҜ№дәҺйҖҡиҝҮжҠ•иҜүз”өиҜқе’ҢжқҘдәәеҪ“йқўжҠ•иҜүдёҫжҠҘзҡ„пјҢйҰ–й—®иҙЈд»»дәәеә”дё»еҠЁеҗ‘жқҘз”өжқҘи®ҝдәәе‘ҳе‘ҠзҹҘиҮӘе·ұзҡ„姓еҗҚгҖҒиҒҢиҙЈпјҢи®Өзңҹеҗ¬еҸ–жқҘз”өжқҘи®ҝдәәзҡ„ж„Ҹи§ҒгҖҒиҰҒжұӮпјҢ并еҒҡеҘҪзҷ»и®°е’Ңи®°еҪ•;еҜ№дҝЎеҮҪгҖҒз”өеӯҗйӮ®д»¶жҠ•иҜүдёҫжҠҘзҡ„пјҢиҰҒйҖҗ件и®Өзңҹзҷ»и®°пјҢе°ҶжҠ•иҜүдёҫжҠҘжқҗж–ҷеҸҠж—¶йҖҒйўҶеҜјжү№йҳ…пјҢйңҖиҪ¬еҠһгҖҒдәӨеҠһзҡ„пјҢеҲ¶дҪңдәӨеҠһеҮҪиҪ¬жүҝеҠһиӮЎе®ӨжүҖеҠһзҗҶгҖӮеұҖеҠһе…¬е®ӨиҰҒеҜ№дҝЎи®ҝжҠ•иҜүгҖҒдәәеӨ§е’Ңж”ҝеҚҸжҸҗжЎҲи®®жЎҲгҖҒеёӮй•ҝдҝЎз®ұдәӨеҠһеҚ•зӯүеҠһзҗҶжғ…еҶөиҝӣиЎҢи·ҹиёӘгҖҒзқЈеҜјгҖҒеӣһеӨҚпјҢиҰҒе°ҪйҮҸеңЁи§„е®ҡжңҹйҷҗеҶ…жҸҗеүҚе®ҢжҲҗгҖӮ
пјҲдәҢпјүе®Ңе–„е·ҘдҪңеҲ¶еәҰпјҢз®ҖеҢ–еҠһдәӢжөҒзЁӢгҖӮдёҘж јжҢүз…§еҺҝйЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖжңәе…іеҶ…йғЁз®ЎзҗҶеҲ¶еәҰгҖҒдҝЎи®ҝжҠ•иҜүеҸ—зҗҶе·ҘдҪңеҲ¶еәҰзӯү规е®ҡеҠһдәӢгҖӮеҜ№жүҖжңүе®Ўжү№дәӢйЎ№е®һиЎҢдёҖж¬ЎжҖ§е‘ҠзҹҘеҲ¶еәҰпјӣжҠ•иҜүз”өиҜқиҰҒеҒҡеҲ°дёҖиҲ¬жғ…еҶөдёӢ7дёӘе·ҘдҪңж—ҘеҶ…еҸҚйҰҲпјҢзү№ж®Ҡжғ…еҶөдёӢеә”еҗ‘з”іиҜ·дәәи§ЈйҮҠжё…жҘҡпјҢеҫҒеҫ—зҗҶи§ЈпјҢж—¶й—ҙдёҚи¶…иҝҮ10дёӘе·ҘдҪңж—ҘгҖӮдёҠзә§йғЁй—ЁиҪ¬еҠһзҡ„жҠ•иҜүдёҫжҠҘй—®йўҳпјҢиҰҒжұӮи°ғжҹҘдәҶи§Јзҡ„пјҢеә”еңЁ5дёӘе·ҘдҪңж—ҘеҶ…еҸҠж—¶еҸҚйҰҲжғ…еҶөпјҢиҰҒжұӮжҠҘз»“жһңзҡ„пјҢиҰҒжҢү照规е®ҡзҡ„жңҹйҷҗеҸҠж—¶жҠҘйҖҒи°ғжҹҘеӨ„зҗҶжғ…еҶөгҖӮ
пјҲдёүпјүзј–еҲ¶еҠһдәӢжҢҮеҚ—пјҢе…¬зӨәжүҝиҜәеҶ…е®№гҖӮе…ЁеҠӣжү“йҖ вҖңйҳіе…үиҚҜзӣ‘вҖқпјҢеңЁеҺҝеұҖзҪ‘з«ҷдёҠе…¬еёғеҠһдәӢжөҒзЁӢпјҢе…¬еёғе®Ўжү№е’ҢжңҚеҠЎдәӢйЎ№еҠһзҗҶжүҝиҜәпјӣеңЁеұҖеҠһе…¬еңәжүҖе…¬е‘ҠзүҢдёҠе…¬еёғеҠһдәӢжҢҮеҚ—гҖҒеҠһдәӢзЁӢеәҸпјҢжҳҺзЎ®еҠһдәӢиҙЈд»»дё»дҪ“гҖҒжқЎд»¶гҖҒж ҮеҮҶиҢғеӣҙгҖҒеҠһзҗҶж—¶йҷҗгҖҒзӣ‘зқЈжё йҒ“зӯүеҶ…е®№пјҢеҗҢж—¶ж №жҚ®е·ҘдҪңйңҖиҰҒпјҢеҲ¶дҪңе®Јдј еҚ•гҖҒеҠһдәӢжҢҮеҚ—жүӢеҶҢгҖҒеұ•жқҝпјҢдёҚе®ҡжңҹеҗ‘зҫӨдј—еҸ‘ж”ҫжҲ–еұ•зӨәгҖӮ
пјҲеӣӣпјүжҳҺзЎ®еІ—дҪҚиҒҢиҙЈпјҢжҸҗй«ҳеҠһдәӢж•ҲзҺҮгҖӮеҜ№жүҖеҸҚжҳ зҡ„еұһдәҺжң¬иӮЎе®ӨжүҖе·ҘдҪңиҢғеӣҙзҡ„дәӢйЎ№пјҢе°ҪеҸҜиғҪз«ӢеҚіеҠһзҗҶжҲ–и§ЈеҶі;еҪ“ж—¶дёҚиғҪеҠһзҗҶжҲ–и§ЈеҶізҡ„пјҢеә”и®ІжҳҺеҺҹеӣ е’Ңи§ЈеҶіж—¶йҷҗпјҢ并еңЁж—¶йҷҗеҶ…иҙҹиҙЈзӯ”еӨҚ;з”іиҜ·жқҗж–ҷдёҚйҪҗе…ЁжҲ–иҖ…дёҚз¬ҰеҗҲжі•е®ҡеҪўејҸзҡ„пјҢеә”еҪ“е…Ғи®ёз”іиҜ·дәәжӣҙжӯЈжҲ–иЎҘйҪҗпјҢйҖҫжңҹдёҚе‘ҠзҹҘзҡ„пјҢиҮӘ收еҲ°з”іиҜ·жқҗж–ҷд№Ӣж—Ҙиө·еҚідёәеҸ—зҗҶпјӣеҜ№жүҖеҸҚжҳ дёҚеұһдәҺиҙЈд»»дәәиӮЎе®ӨжүҖе·ҘдҪңиҢғеӣҙзҡ„дәӢйЎ№пјҢеә”дәҲд»Ҙзҷ»и®°пјҢ并е‘ҠзҹҘдёҚдәҲеҸ—зҗҶзҡ„зҗҶз”ұпјҢе‘ҠзҹҘе…¶еә”еҗ‘е“ӘдёӘиӮЎе®ӨжүҖгҖҒе“ӘдёӘйғЁй—ЁеҸҚжҳ е’ҢжҠ•иҜүпјҢеұһйҮҚеӨ§й—®йўҳзҡ„пјҢеә”еҗ‘еұҖйўҶеҜјжұҮжҠҘпјҢз”ұеұҖйўҶеҜје®үжҺ’еҗ‘жңүе…ійғЁй—ЁиҪ¬дәӨгҖӮ
пјҲдә”пјүеҠ еӨ§е®Јдј еҠӣеәҰпјҢе®Ңе–„зӣ‘зқЈжңәеҲ¶гҖӮз§ҜжһҒй…ҚеҗҲеҺҝ委гҖҒеҺҝж”ҝеәңгҖҒеёӮеұҖеҒҡеҘҪвҖң马дёҠе°ұеҠһвҖқжҙ»еҠЁзҡ„иҲҶи®әе®Јдј е·ҘдҪңпјҢе……еҲҶеҲ©з”Ёеҗ„зұ»еӘ’д»Ӣе…¬еёғжҠ•иҜүз”өиҜқе’Ңе…¬ејҖжүҝиҜәпјҢй’ҲеҜ№зҫӨдј—еҸҚжҳ зҡ„зғӯзӮ№гҖҒйҡҫзӮ№й—®йўҳдәҲд»Ҙи§ЈеҶіе№¶еҸҠж—¶е…¬еёғгҖӮеҗҢж—¶иҰҒе®Ңе–„зӣ‘зқЈжңәеҲ¶пјҢиҗҪе®һз»©ж•ҲиҖғж ёпјҢеҠ ејәеҶ…йғЁзқЈеҜҹпјҢе®ҡжңҹеҚ°еҸ‘е·ҘдҪңз®ҖжҠҘпјҢдёҘиӮғжҹҘеӨ„е·ҘдҪңдҪңйЈҺзІ—жҡҙпјҢж»Ҙз”ЁиҒҢжқғд»ҘеҸҠвҖңеҗғгҖҒжӢҝгҖҒеҚЎгҖҒиҰҒвҖқзӯүзҺ°иұЎпјӣз§ҜжһҒжҺҘеҸ—зӨҫдјҡеҗ„з•Ңзӣ‘зқЈжҠ•иҜүпјҢеҜ№дәӨеҠһзҡ„жҠ•иҜүдёҫжҠҘдәӢйЎ№пјҢиҰҒе®һиЎҢйҮҚзӮ№жҠҪжҹҘеҲ¶еәҰпјҢ并е®ҡжңҹеҜ№жҠ•иҜүдёҫжҠҘдәәиҝӣиЎҢеӣһи®ҝпјҢзЎ®дҝқзҫӨдј—еҸҚжҳ зҡ„й—®йўҳдәӢдәӢжңүеӣһйҹіпјҢ件件жңүзқҖиҗҪгҖӮ
еӣӣгҖҒж–№жі•дёҺжӯҘйӘӨ
жҢүз…§жҲ‘еҺҝвҖң马дёҠе°ұеҠһвҖқжҙ»еҠЁзҡ„жҖ»дҪ“иҰҒжұӮе’Ңз»ҹдёҖе®үжҺ’пјҢз»“еҗҲжҲ‘еҺҝйЈҹе“ҒиҚҜе“Ғзӣ‘з®Ўе·ҘдҪңе®һйҷ…пјҢжҙ»еҠЁеҲҶд»ҘдёӢдёүдёӘйҳ¶ж®өиҝӣиЎҢпјҡ
пјҲдёҖпјүеҠЁе‘ҳйғЁзҪІйҳ¶ж®өпјҲ2016е№ҙ8жңҲ15ж—ҘеүҚпјүгҖӮдёҖжҳҜеҲ¶е®ҡдёӢеҸ‘гҖҠејҖеұ•вҖң马дёҠе°ұеҠһвҖқжҙ»еҠЁе®һж–Ҫж–№жЎҲгҖӢпјҢеҜ№жҙ»еҠЁиҝӣиЎҢе…ЁйқўйғЁзҪІпјҢдҪҝе№ҝеӨ§е№ІйғЁжҸҗй«ҳи®ӨиҜҶпјҢжҳҺзЎ®жҙ»еҠЁејҖеұ•зҡ„еҹәжң¬иҰҒжұӮе’Ңдё»иҰҒеҶ…е®№гҖӮиҰҒиҝӣдёҖжӯҘејәеҢ–жҺӘж–ҪпјҢйҮҮеҸ–еӨҡз§Қж–№ејҸпјҢе®Јдј пјҢж•ҷиӮІе’Ңеј•еҜјжңәе…іе№ІйғЁиҒҢе·Ҙе……еҲҶи®ӨиҜҶжҙ»еҠЁејҖеұ•зҡ„йҮҚеӨ§ж„Ҹд№үпјҢжҳҺзЎ®е·ҘдҪңзӣ®ж ҮгҖҒйҮҚзӮ№д»»еҠЎгҖҒж–№жі•жӯҘйӘӨе’Ңе·ҘдҪңиҰҒжұӮпјҢжҠҠжҖқжғіе’ҢиЎҢеҠЁз»ҹдёҖеҲ°вҖң马дёҠе°ұеҠһвҖқжҙ»еҠЁзҡ„зІҫзҘһдёҠжқҘгҖӮ
пјҲдәҢпјүз»„з»Үе®һж–Ҫйҳ¶ж®өпјҲ2016е№ҙ11жңҲ30ж—ҘеүҚпјүгҖӮдёҖжҳҜеңЁеҺҝж”ҝеәңдҝЎжҒҜе…¬ејҖе№іеҸ°дёҠеҗ‘зӨҫдјҡе…¬ејҖжүҝиҜәжңҚеҠЎеҶ…е®№гҖӮдәҢжҳҜи®ӨзңҹжҹҘжүҫеңЁиЎҢж”ҝж•ҲиғҪзҡ„жҖқжғіи§ӮеҝөгҖҒе·ҘдҪңдҪңйЈҺгҖҒдҪ“еҲ¶жңәеҲ¶гҖҒз®ЎзҗҶж–№ејҸзӯүж–№йқўзҡ„зӘҒеҮәй—®йўҳгҖӮдёүжҳҜеҲҮе®һи§ЈеҶіеҪұе“Қе’ҢеҰЁзўҚжңәе…іж•ҲиғҪе»әи®ҫжҡЁвҖң马дёҠе°ұеҠһвҖқжҙ»еҠЁзҡ„зӘҒеҮәй—®йўҳгҖӮеӣӣжҳҜеҜ№е…ЁеұҖејҖеұ•вҖң马дёҠе°ұеҠһвҖқжҙ»еҠЁиҝӣиЎҢжҳҺжҹҘжҡ—и®ҝпјҢеҜ№жҖҒеәҰз”ҹзЎ¬гҖҒеҠһдәӢжӢ–жІ“гҖҒжҺЁиҜҝжүҜзҡ®зҡ„пјҢйҖҡиҝҮж”ҝеҠЎе…¬ејҖж Ҹе…¬ејҖжӣқе…үпјҢ并иҝҪ究зӣёе…ідәәе‘ҳзҡ„иҙЈд»»гҖӮдә”жҳҜиҰҒиҝӣдёҖжӯҘе®Ңе–„жҸҗй«ҳжңәе…іж•ҲиғҪе»әи®ҫзҡ„еҗ„йЎ№з®ЎзҗҶеҲ¶еәҰгҖӮ
пјҲдёүпјүжҖ»з»“жҸҗй«ҳйҳ¶ж®өпјҲ2016е№ҙ12жңҲ30ж—ҘеүҚпјүгҖӮеҗ„иӮЎе®ӨгҖҒжүҖеҜ№з…§еҺҝйҮҢеҸҠжң¬еұҖж–№жЎҲиҰҒжұӮпјҢиҝӣиЎҢиҮӘжҹҘиҮӘзә пјҢеҜ№жІЎжңүиҫҫеҲ°зӣ®ж Үзҡ„пјҢеҸҠж—¶иҝӣиЎҢж•ҙж”№пјҢеҜ№еңЁжү§иЎҢиҝҮзЁӢдёӯеҸ‘зҺ°зҡ„ж–°жғ…еҶөгҖҒж–°й—®йўҳпјҢиҰҒиҝӣдёҖжӯҘдҝ®и®ўдёҺе®Ңе–„вҖң马дёҠе°ұеҠһвҖқзҡ„еҗ„йЎ№еҲ¶еәҰдёҺиҰҒжұӮпјҢеҺҝеұҖйўҶеҜје°Ҹз»„иҰҒйҖӮж—¶ејҖеұ•еҶ…йғЁзқЈжҹҘпјҢеҸ‘зҺ°й—®йўҳпјҢдёҘиӮғеӨ„зҗҶгҖӮ
дә”гҖҒжҙ»еҠЁиҰҒжұӮ
пјҲдёҖпјүеҠ ејәз»„з»ҮйўҶеҜјгҖӮжҲҗз«Ӣз”ұеұҖдё»иҰҒйўҶеҜјд»»з»„й•ҝгҖҒеҗ„еҲҶз®ЎйўҶеҜјд»»еүҜз»„й•ҝзҡ„вҖң马дёҠе°ұеҠһвҖқжҙ»еҠЁйўҶеҜје°Ҹз»„пјҢеҗ„иӮЎе®ӨгҖҒжүҖиҙҹиҙЈдәәдёәжҲҗе‘ҳпјҢдёӢи®ҫеҠһе…¬е®Ө(и®ҫеңЁеұҖеҠһе…¬е®Ө)пјҢиҙҹиҙЈжҙ»еҠЁзҡ„ж—Ҙеёёе·ҘдҪңгҖӮеҗ„иӮЎе®ӨжүҖиҰҒжҠҠејҖеұ•вҖң马дёҠе°ұеҠһвҖқжҙ»еҠЁдҪңдёәж–°еҪўеҠҝдёӢж·ұе…ҘеӯҰд№ е®һи·өе…ҡзҡ„еҚҒе…«еӨ§зІҫзҘһе’ҢејҖеұ•е…ҡзҡ„зҫӨдј—и·Ҝзәҝж•ҷиӮІе®һи·өжҙ»еҠЁйҮҚиҰҒдёҫжҺӘпјҢдҪңдёәдҝғиҝӣжҲ‘еҺҝйЈҹе“ҒиҚҜе“Ғзӣ‘з®ЎеҸ‘еұ•зҡ„дёҖйЎ№е…ЁеұҖжҖ§е·ҘдҪңпјҢеҲҮе®һжҠ“еҘҪиҗҪе®һпјҢзЎ®дҝқжҙ»еҠЁжңүеәҸејҖеұ•гҖӮ
пјҲдәҢпјүжҠҠжҸЎжҙ»еҠЁе®һиҙЁгҖӮж·ұеҲ»и®ӨиҜҶејҖеұ•вҖң马дёҠе°ұеҠһвҖқжҙ»еҠЁзҡ„йҮҚеӨ§ж„Ҹд№үпјҢвҖң马дёҠе°ұеҠһвҖқзҡ„ж ёеҝғжҳҜе…Ёеҝғе…Ёж„Ҹдёәдәәж°‘жңҚеҠЎпјҢеӨ–еңЁиЎЁзҺ°жҳҜеҝ«иҠӮеҘҸгҖҒй«ҳж•ҲзҺҮпјҢе·ҘдҪңдёӯвҖңз«ӢиҜҙз«ӢиЎҢгҖҒ马дёҠе°ұеҠһгҖҒйҷҗж—¶еҠһз»“гҖҒеҠһе°ұеҠһеҘҪвҖқгҖӮвҖң马дёҠе°ұеҠһвҖқдёҚжҳҜ马дёҠе°ұеҠһз»“пјҢиҖҢжҳҜз«ӢеҚіеҗҜеҠЁеҠһдәӢзЁӢеәҸпјҢиғҪеҠһзҡ„з«ӢеҚіеҠһеҘҪпјҢдёҚиғҪеҠһзҡ„и§ЈйҮҠжё…жҘҡпјҢжңүжі•е®ҡж—¶йҷҗзҡ„еңЁжңҖзҹӯж—¶йҷҗеҶ…еҠһз»“гҖӮеҗҢж—¶иҰҒеҠ еӨ§иҲҶи®әе®Јдј пјҢе……еҲҶеҲ©з”Ёж”ҝеҠЎзҪ‘з«ҷгҖҒж”ҝеҠЎе…¬ејҖж Ҹзӯүе®Јдј йҳөең°пјҢе№ҝжіӣе®Јдј вҖң马дёҠе°ұеҠһвҖқжҙ»еҠЁпјҢе……еҲҶеұ•зӨәжңәе…іе№ІйғЁзҡ„еҙӯж–°йЈҺиІҢпјҢж ‘з«Ӣжңәе…ізҡ„иүҜеҘҪеҪўиұЎгҖӮ
пјҲдёүпјүзӘҒеҮәе·ҘдҪңйҮҚзӮ№гҖӮдёҖжҳҜд»ҘжӯӨж¬Ўжҙ»еҠЁдёәеҘ‘жңәпјҢеҮәе®һжӢӣгҖҒз”Ёе®һеҠІпјҢеҲҮе®һи§ЈеҶізҫӨдј—еҸҚжҳ ејәзғҲзҡ„зғӯзӮ№гҖҒйҡҫзӮ№й—®йўҳгҖӮдәҢжҳҜеҠ еӨ§еҠӣеәҰпјҢејәеҢ–жҺӘж–ҪпјҢдјҳеҢ–жңҚеҠЎпјҢй’ҲеҜ№зҫӨдј—еҸҚжҳ зҡ„зғӯзӮ№й—®йўҳе’ҢдјҳеҢ–еҸ‘еұ•зҺҜеўғдёӯзҡ„йҡҫзӮ№й—®йўҳпјҢиҝӣиЎҢи®Өзңҹз ”з©¶гҖҒеҗҲзҗҶи§ЈеҶіпјҢеҠӘеҠӣеҲӣйҖ дјҳиүҜзҡ„еҸ‘еұ•зҺҜеўғгҖӮ
пјҲеӣӣпјүжіЁйҮҚжҙ»еҠЁе®һз»©гҖӮжҠҠжҸЎе·ҘдҪңйҮҚзӮ№е’ҢиҰҒжұӮпјҢи®ӨзңҹеұҘиЎҢиҒҢиҙЈпјҢеҠӣжҲ’жө®еҚҺпјҢдёҚиө°иҝҮеңәпјҢдёҚжҗһеҪўејҸпјҢе»әз«Ӣзҡ„еҲ¶еәҰе’ҢеҲ¶е®ҡзҡ„жҺӘж–ҪйғҪиҰҒиҗҪе®һпјҢеҒҡеҲ°жңүиҜәеҝ…и·өпјҢжңүиЎҢеҝ…жһңгҖӮ
第3зҜҮдёҖгҖҒжҖ»дҪ“зӣ®ж Ү
ж·ұе…ҘиҙҜеҪ»иҗҪе®һгҖҠйЈҹе“Ғе®үе…Ёжі•гҖӢгҖҒгҖҠеҲ‘жі•дҝ®жӯЈжЎҲпјҲе…«пјүгҖӢе’ҢгҖҠеӣҪеҠЎйҷўе…ідәҺеҠ ејәйЈҹе“Ғзӯүдә§е“Ғе®үе…Ёзӣ‘зқЈз®ЎзҗҶзҡ„зү№еҲ«и§„е®ҡгҖӢпјҲдёӢз§°гҖҠзү№еҲ«и§„е®ҡгҖӢпјүзӯүжі•еҫӢ法规дёӯжңүе…ідҝқеҒҘйЈҹе“Ғзӣ‘з®Ўзҡ„规е®ҡпјҢжҢүз…§ж•ҙжІ»гҖҒжғ©еӨ„е’Ң规иҢғзӣёз»“еҗҲзҡ„жҖ»дҪ“иҰҒжұӮпјҢеҲ©з”ЁеӣӣдёӘжңҲж—¶й—ҙйӣҶдёӯејҖеұ•дё“йЎ№иЎҢеҠЁпјҢд»Ҙжү“еҮ»вҖңеӣӣйқһвҖқгҖҒжӢ’з»қеҒҮеҠЈгҖҒеҮҖеҢ–еёӮеңәгҖҒдҝқйҡңе®үе…Ёдёәдё»иҰҒзӣ®ж ҮпјҢд»ҘйҮҚзӮ№дә§е“ҒгҖҒйҮҚзӮ№дјҒдёҡгҖҒйҮҚзӮ№еҢәеҹҹгҖҒйҮҚзӮ№жЎҲ件дёәзӘҒз ҙеҸЈпјҢйҮҮеҸ–ж‘ёеә•жҺ’жҹҘгҖҒзӘҒеҮ»жЈҖжҹҘгҖҒе…¬ејҖжӣқе…үзҡ„ж–№ејҸпјҢдё»еҠЁеҮәеҮ»пјҢйҮҚе…ёжІ»д№ұпјҢеңЁе…ЁеҺҝиҢғеӣҙеҶ…еҪўжҲҗжү“еҮ»дҝқеҒҘйЈҹе“Ғз”ҹдә§з»ҸиҗҘиҝқжі•иҝқ规иЎҢдёәй«ҳеҺӢжҖҒеҠҝпјҢдҝғиҝӣдҝқеҒҘйЈҹе“Ғз”ҹдә§з»ҸиҗҘ秩еәҸиҝӣдёҖжӯҘеҘҪиҪ¬гҖӮ
дәҢгҖҒжү“еҮ»йҮҚзӮ№е’Ңжі•еҫӢдҫқжҚ®
дёәзЎ®дҝқжү“еҮ»жңүеҠӣгҖҒж”ҝзӯ–з»ҹдёҖпјҢеҗ„ең°иҰҒдёҘж јжү§иЎҢгҖҠйЈҹе“Ғе®үе…Ёжі•гҖӢгҖҒгҖҠеҲ‘жі•дҝ®жӯЈжЎҲпјҲе…«пјүгҖӢгҖҒгҖҠзү№еҲ«и§„е®ҡгҖӢзӯүжі•еҫӢ法规зҡ„规е®ҡгҖӮеңЁжӯӨж¬Ўдё“йЎ№иЎҢеҠЁдёӯпјҢеҸ‘зҺ°вҖңеӣӣйқһвҖқиЎҢдёәзҡ„пјҢдёҖеҫӢжҢүжі•еҫӢ法规规е®ҡзҡ„дёҠйҷҗдәҲд»ҘеӨ„зҪҡпјӣжғ…иҠӮдёҘйҮҚзҡ„пјҢдёҖеҫӢеҗҠй”Җз”ҹдә§з»ҸиҗҘиҖ…е’Ңдә§е“Ғзҡ„и®ёеҸҜиҜҒ件пјӣж¶үеҸҠзҠҜзҪӘзҡ„пјҢдёҖеҫӢ移йҖҒе…¬е®үжңәе…ідҫқжі•иҝҪ究еҲ‘дәӢиҙЈд»»пјӣеҜ№еӯҳеңЁе®үе…ЁйҡҗжӮЈзҡ„дә§е“ҒпјҢдёҖеҫӢе°ҒеӯҳгҖҒдёӢжһ¶гҖҒиҙЈд»ӨдјҒдёҡеҸ¬еӣһ并зӣ‘зқЈй”ҖжҜҒгҖӮ
е®һж–ҪиЎҢж”ҝеӨ„зҪҡзҡ„е…·дҪ“иҰҒжұӮжҳҜпјҡ
пјҲдёҖпјүжү“еҮ»дҝқеҒҘйЈҹе“Ғйқһжі•з”ҹдә§иЎҢдёәгҖӮеҸ‘зҺ°дёӢеҲ—жғ…еҪўзҡ„пјҢжҢүгҖҠйЈҹе“Ғе®үе…Ёжі•гҖӢ第八еҚҒеӣӣжқЎгҖҒе…«еҚҒдә”жқЎгҖҒе…«еҚҒе…ӯжқЎгҖҒе…«еҚҒдёғжқЎе’ҢгҖҠеҲ‘жі•дҝ®жӯЈжЎҲпјҲе…«пјүгҖӢ第дәҢеҚҒеӣӣжқЎгҖҒдәҢеҚҒдә”жқЎзӣёеә”规е®ҡдәҲд»ҘеӨ„зҪҡпјҡ
1.ең°дёӢй»‘зӘқзӮ№з”ҹдә§дҝқеҒҘйЈҹе“Ғзҡ„пјӣ
2.дјҒдёҡжңӘз»Ҹи®ёеҸҜз”ҹдә§дҝқеҒҘйЈҹе“Ғзҡ„пјӣ
3.еңЁз”ҹдә§иҝҮзЁӢдёӯеҒ·е·ҘеҮҸж–ҷгҖҒжҺәжқӮжҺәеҒҮжҲ–иҖ…дёҚжҢүз…§жү№еҮҶеҶ…е®№з”ҹдә§дҝқеҒҘйЈҹе“Ғзҡ„пјӣ
4.з”ҹдә§зҡ„дҝқеҒҘйЈҹе“ҒеӯҳеңЁйҮҚйҮ‘еұһгҖҒеҫ®з”ҹзү©и¶…ж ҮзӯүиҙЁйҮҸй—®йўҳзҡ„пјӣ
5.иҝқжі•иҝқ规委жүҳз”ҹдә§зҡ„гҖӮ
йҒҮжңүзү№ж®Ҡжғ…еҪўпјҢдёҚиғҪйҖӮз”ЁгҖҠйЈҹе“Ғе®үе…Ёжі•гҖӢгҖҒгҖҠеҲ‘жі•дҝ®жӯЈжЎҲпјҲе…«пјүгҖӢ规е®ҡзҡ„пјҢдҫқз…§гҖҠзү№еҲ«и§„е®ҡгҖӢ第дёүжқЎгҖҒеӣӣжқЎгҖҒдә”жқЎзӣёеә”规е®ҡдәҲд»ҘеӨ„зҪҡгҖӮ
пјҲдәҢпјүжү“еҮ»дҝқеҒҘйЈҹе“Ғйқһжі•з»ҸиҗҘиЎҢдёәгҖӮеҸ‘зҺ°дёӢеҲ—жғ…еҪўзҡ„пјҢжҢүгҖҠйЈҹе“Ғе®үе…Ёжі•гҖӢ第八еҚҒеӣӣжқЎгҖҒе…«еҚҒдә”жқЎгҖҒе…«еҚҒе…ӯжқЎгҖҒе…«еҚҒдёғжқЎгҖҒд№қеҚҒжқЎе’ҢгҖҠеҲ‘жі•дҝ®жӯЈжЎҲпјҲе…«пјүгҖӢ第дәҢеҚҒеӣӣжқЎгҖҒдәҢеҚҒдә”жқЎзӣёеә”规е®ҡдәҲд»ҘеӨ„зҪҡпјҡ
1.жңӘз»ҸйЈҹе“ҒжөҒйҖҡи®ёеҸҜжҲ–дҝқеҒҘйЈҹе“ҒжөҒйҖҡи®ёеҸҜз»ҸиҗҘдҝқеҒҘйЈҹе“Ғзҡ„пјӣ
2.з»ҸиҗҘеҒҮеҶ’дҝқеҒҘйЈҹе“Ғж–ҮеҸ·гҖҒж Үеҝ—д»ҘеҸҠжңӘз»Ҹжү№еҮҶеЈ°з§°зү№е®ҡдҝқеҒҘеҠҹиғҪдә§е“Ғзҡ„пјӣ
3.з»ҸиҗҘдҝқеҒҘйЈҹе“Ғдә§е“ҒиҙЁйҮҸдёҚеҗҲж јжҲ–жқҘжәҗдёҚжҳҺзҡ„пјӣ
4.д»Ҙдјҡи®®гҖҒи®Іеә§зӯүеҪўејҸиҝқжі•й”Җе”®дҝқеҒҘйЈҹе“Ғзҡ„пјӣ
5.еёӮеңәејҖеҠһиҖ…еҜ№е…Ҙеңәзҡ„дҝқеҒҘйЈҹе“Ғз»ҸиҗҘиҖ…жңӘеұҘиЎҢеёӮеңәејҖеҠһиҙЈд»»зҡ„гҖӮ
йҒҮжңүзү№ж®Ҡжғ…еҪўпјҢдёҚиғҪйҖӮз”ЁгҖҠйЈҹе“Ғе®үе…Ёжі•гҖӢгҖҒгҖҠеҲ‘жі•дҝ®жӯЈжЎҲпјҲе…«пјүгҖӢ规е®ҡзҡ„пјҢдҫқз…§гҖҠзү№еҲ«и§„е®ҡгҖӢ第дёүжқЎгҖҒеӣӣжқЎгҖҒдә”жқЎзӣёеә”规е®ҡдәҲд»ҘеӨ„зҪҡгҖӮ
пјҲдёүпјүжү“еҮ»дҝқеҒҘйЈҹе“Ғйқһжі•ж·»еҠ иЎҢдёәгҖӮеҸ‘зҺ°дёӢеҲ—жғ…еҪўзҡ„пјҢжҢүгҖҠйЈҹе“Ғе®үе…Ёжі•гҖӢ第八еҚҒдә”жқЎгҖҒе…«еҚҒе…ӯжқЎе’ҢгҖҠеҲ‘жі•дҝ®жӯЈжЎҲпјҲе…«пјүгҖӢ第дәҢеҚҒеӣӣжқЎгҖҒдәҢеҚҒдә”жқЎзӣёеә”规е®ҡдәҲд»ҘеӨ„зҪҡпјҡ
1.еңЁз”ҹдә§еҮҸиӮҘгҖҒиҫ…еҠ©йҷҚиЎҖзі–гҖҒзј“и§ЈдҪ“еҠӣз–ІеҠігҖҒиҫ…еҠ©йҷҚиЎҖеҺӢзӯүдҝқеҒҘйЈҹе“Ғдёӯйқһжі•ж·»еҠ иҚҜзү©зҡ„пјӣ
2.жҳҺзҹҘдҝқеҒҘйЈҹе“ҒеӯҳеңЁйқһжі•ж·»еҠ иҚҜзү©пјҢд»Қ然继з»ӯз»ҸиҗҘзҡ„гҖӮ
пјҲеӣӣпјүжү“еҮ»дҝқеҒҘйЈҹе“Ғйқһжі•е®Јдј иЎҢдёәгҖӮеҸ‘зҺ°дёӢеҲ—жғ…еҪўзҡ„пјҢжҢүгҖҠйЈҹе“Ғе®үе…Ёжі•гҖӢ第八еҚҒдёғжқЎгҖҒд№қеҚҒеӣӣжқЎзӣёеә”规е®ҡдәҲд»ҘеӨ„зҪҡпјҡ
1.еңЁдҝқеҒҘйЈҹе“Ғж ҮзӯҫгҖҒиҜҙжҳҺд№ҰгҖҒе№ҝе‘ҠдёӯеӨёеӨ§еҠҹиғҪиҢғеӣҙзҡ„пјӣ
2.е®Јз§°дҝқеҒҘйЈҹе“Ғе…·жңүз–ҫз—…йў„йҳІжҲ–жІ»з–—еҠҹиғҪзҡ„пјӣ
3.иҷҡжһ„дҝқеҒҘйЈҹе“Ғзӣ‘еҲ¶гҖҒеҮәе“ҒгҖҒжҺЁиҚҗеҚ•дҪҚдҝЎжҒҜзҡ„пјӣ
4.жңӘз»Ҹе®ЎжҹҘеҸ‘еёғдҝқеҒҘйЈҹе“Ғе№ҝе‘Ҡзҡ„пјӣ
5.дёҚжҢүз…§дҝқеҒҘйЈҹе“Ғе№ҝе‘Ҡе®ЎжҹҘеҶ…е®№еҸ‘еёғе№ҝе‘Ҡзҡ„гҖӮ
дёүгҖҒе®һж–ҪжӯҘйӘӨеҸҠе·ҘдҪңе®үжҺ’
жӯӨж¬Ўдё“йЎ№иЎҢеҠЁд»Һ2016е№ҙ6жңҲеҲқејҖе§ӢиҮі9жңҲеә•пјҢеҲҶдёәжЈҖжҹҘж•ҙжІ»гҖҒжЎҲ件жҹҘеҠһе’Ң规иҢғжҸҗй«ҳдёүдёӘйҳ¶ж®өгҖӮдёүдёӘйҳ¶ж®өзҡ„е·ҘдҪңд»»еҠЎдә’дёәиЎ”жҺҘпјҢж—¶й—ҙиҝӣеәҰжңҚд»Һе·ҘдҪңиҙЁйҮҸпјҢйҮҚеңЁи§ЈеҶій—®йўҳе’ҢжҺ’йҷӨйҡҗжӮЈпјҢдёҚжҗһдёҖйҳөйЈҺпјҢе…¶дёӯжЈҖжҹҘж•ҙжІ»гҖҒжЎҲ件жҹҘеҠһдёӨдёӘйҳ¶ж®өзҡ„дё»иҰҒе·ҘдҪңд»»еҠЎеҠӣдәүеңЁ8жңҲеә•еүҚе®ҢжҲҗпјҢ规иҢғжҸҗй«ҳйҳ¶ж®өзҡ„дё»иҰҒе·ҘдҪңд»»еҠЎеҠӣдәүеңЁ9жңҲ20ж—ҘеүҚе®ҢжҲҗгҖӮ
пјҲдёҖпјүжЈҖжҹҘж•ҙжІ»йҳ¶ж®өпјҢдё»иҰҒд»»еҠЎжҳҜпјҡ
1.еңЁз»„з»Үж‘ёеә•и°ғжҹҘзҡ„еҹәзЎҖдёҠпјҢжҳҺзЎ®дё“йЎ№иЎҢеҠЁж–№жЎҲпјҢзЎ®е®ҡвҖңйҮҚзӮ№зӣ‘зқЈжЈҖжҹҘзҡ„дә§е“ҒеҸҠдјҒдёҡеҗҚеҚ•гҖӮ
2.жҢүз…§еёӮеұҖзҡ„з»ҹдёҖйғЁзҪІпјҢеҲ¶е®ҡжҲ‘еҺҝзҡ„е…·дҪ“е®һж–Ҫж–№жЎҲпјҢй…ҚеҗҲеёӮеұҖе®ҢжҲҗйЈһиЎҢжЈҖжҹҘд»»еҠЎгҖӮеҗҢж—¶пјҢз»“еҗҲжң¬ең°ж—Ҙеёёзӣ‘з®ЎгҖҒйЈҺйҷ©зӣ‘жөӢе’ҢжҠ•иҜүдёҫжҠҘе·ҘдҪңжғ…еҶөпјҢеҲ¶е®ҡвҖңиҫ–еҢәеҶ…йҮҚзӮ№зӣ‘зқЈжЈҖжҹҘзҡ„дә§е“ҒеҸҠдјҒдёҡеҗҚеҚ•вҖқпјҢ并иҝӣиЎҢжҡ—и®ҝжҡ—жҹҘе’ҢзӘҒеҮ»жЈҖжҹҘпјҢдәҺ2016е№ҙ6жңҲ14ж—ҘеүҚпјҢе°ҶйҮҚзӮ№зӣ‘зқЈжЈҖжҹҘзҡ„дә§е“ҒеҸҠдјҒдёҡеҗҚеҚ•дёҠжҠҘеёӮеұҖгҖӮ
3.жҢүз…§з»ҹдёҖйғЁзҪІпјҢеҠ еӨ§еҜ№иҫ–еҢәеҶ…дҝқеҒҘйЈҹе“ҒвҖңеӣӣйқһвҖқиЎҢдёәзҡ„зӣ‘зқЈжЈҖжҹҘеҠӣеәҰгҖӮеңЁдё“йЎ№иЎҢеҠЁжңҹй—ҙпјҢеҜ№жҲ‘еҺҝзҡ„дҝқеҒҘйЈҹе“Ғз”ҹдә§дјҒдёҡпјҢзҺ°еңәжЈҖжҹҘиҰҶзӣ–зҺҮиҫҫ100п№ӘпјҢжЈҖжҹҘйў‘ж¬ЎдёҚе°‘дәҺ2ж¬ЎпјӣеҜ№жҲ‘еҺҝзҡ„дҝқеҒҘйЈҹе“Ғжү№еҸ‘еёӮеңәгҖҒеӨ§еһӢи¶…еёӮгҖҒдё“еҚ–еә—гҖҒиҚҜеә—зӯүйҮҚзӮ№з»ҸиҗҘеңәжүҖпјҢзҺ°еңәжЈҖжҹҘиҰҶзӣ–зҺҮиҫҫеҲ°100п№ӘпјҢжЈҖжҹҘйў‘ж¬ЎдёҚе°‘дәҺ2ж¬ЎпјӣеҜ№е…¶д»–дҝқеҒҘйЈҹе“Ғз»ҸиҗҘеҚ•дҪҚзҺ°еңәжЈҖжҹҘиҰҶзӣ–зҺҮдёҚдҪҺдәҺ50п№ӘгҖӮеҜ№жЈҖжҹҘдёӯеҸ‘зҺ°зҡ„иҝқжі•иЎҢдёәпјҢеҲ¶дҪңжЈҖжҹҘ笔еҪ•гҖҒдҝқеӯҳзӣёе…іиҜҒжҚ®гҖҒдҫқжі•иҝӣиЎҢеӨ„зҗҶгҖӮеҜ№еҸ‘зҺ°зҡ„иҝқжі•дҝқеҒҘйЈҹе“Ғе’ҢеҸҜз–‘дә§е“Ғз«ӢеҚідәҲд»ҘжҹҘе°ҒжҲ–жҡӮжҺ§пјҢж¶үеҸҠйқһжі•ж·»еҠ е’ҢеҒҮеҶ’дҝқеҒҘйЈҹе“Ғжү№еҮҶж–ҮеҸ·зҡ„пјҢеҸҠж—¶е°Ҷдә§е“Ғжңүе…ідҝЎжҒҜдёҠжҠҘеёӮеұҖгҖӮ
пјҲдәҢпјүжЎҲ件жҹҘеҠһйҳ¶ж®өпјҢдё»иҰҒд»»еҠЎжҳҜпјҡ
1.еңЁз¬¬дёҖйҳ¶ж®өе·ҘдҪңзҡ„еҹәзЎҖдёҠпјҢжҠ“еҘҪиҝқжі•иҝқ规иЎҢдёәзҡ„з«ӢжЎҲе’ҢжҹҘеӨ„е·ҘдҪңгҖӮж №жҚ®жЈҖжҹҘдёӯеҸ‘зҺ°зҡ„й—®йўҳпјҢиҝҪж №жәҜжәҗпјҢдёҖжҹҘеҲ°еә•пјҢзқҖеҠӣзӘҒз ҙдёҖжү№зҫӨдј—дёҫжҠҘзҡ„зәҝзҙўгҖҒжҹҘеӨ„дёҖжү№иҝқжі•иҝқ规иЎҢдёәгҖҒ移йҖҒдёҖжү№еҲ‘дәӢжЎҲ件пјҢеҪўжҲҗжү“еҮ»иҝқжі•иҝқ规иЎҢдёәзҡ„йңҮж…‘еҠӣгҖӮ
2.е®ҢжҲҗеёӮеұҖдәӨеҠһзҡ„зӣ‘зқЈжЈҖжҹҘд»»еҠЎпјҢдҫқжі•дҪңеҮәеӨ„зҗҶпјҢ并еҸҠж—¶еҗ‘еёӮеұҖжҠҘйҖҒзӣ‘зқЈжЈҖжҹҘе’ҢеӨ„зҗҶз»“жһңгҖӮ
3.еҠ ејәдёҺе·Ҙе•ҶгҖҒе…¬е®үзӯүйғЁй—Ёзҡ„жІҹйҖҡдёҺй…ҚеҗҲгҖӮ
пјҲдёүпјү规иҢғжҸҗй«ҳйҳ¶ж®өпјҢдё»иҰҒд»»еҠЎжҳҜпјҡ
1.еҜ№дё“йЎ№иЎҢеҠЁиҝӣиЎҢйҳ¶ж®өжҖ§жҖ»з»“пјҢй’ҲеҜ№еӯҳеңЁзҡ„зӘҒеҮәй—®йўҳпјҢжҹҘжүҫзӣ‘з®Ўе·ҘдҪңзҡ„жјҸжҙһе’Ңи–„ејұзҺҜиҠӮпјҢзқЈдҝғдјҒдёҡ规иҢғе’ҢеҠ ејәеҶ…йғЁз®ЎзҗҶпјҢиҗҪе®һдјҒдёҡзҡ„дё»дҪ“иҙЈд»»пјҢ继з»ӯдҝқжҢҒжү“еҮ»иҝқжі•иҝқ规иЎҢдёәзҡ„й«ҳеҺӢжҖҒеҠҝпјҢеҲҮе®һе·©еӣәдё“йЎ№иЎҢеҠЁжҲҗжһңгҖӮ
2.еҜ№дё“йЎ№иЎҢеҠЁе·ҘдҪңиҝӣиЎҢжҖ»з»“пјҢеҜ№дёҖдәӣеҘҪз»ҸйӘҢгҖҒеҘҪеҒҡжі•пјҢз”ЁеҲ¶еәҰзҡ„ж–№ејҸеӣәе®ҡдёӢжқҘпјҢеҪўжҲҗй•ҝж•Ҳзӣ‘з®ЎжңәеҲ¶гҖӮ
3гҖҒеңЁдё“йЎ№иЎҢеҠЁдёӯпјҢй’ҲеҜ№зӣ‘з®ЎеҲ¶еәҰгҖҒжі•еҫӢйҖӮз”Ёзӯүж–№йқўзҡ„й—®йўҳе’Ңеӣ°йҡҫпјҢиҰҒеҸҠж—¶дёҺеёӮеұҖжІҹйҖҡиҜ·зӨәпјҢиҝӣдёҖжӯҘе®Ңе–„зӣ‘з®Ўжү§жі•дҫқжҚ®е’ҢжҸҗй«ҳз»јеҗҲжү§жі•иғҪеҠӣгҖӮ
еӣӣгҖҒе·ҘдҪңиҰҒжұӮ
пјҲдёҖпјүеҠ ејәз»„з»ҮйўҶеҜјгҖӮдёәзЎ®дҝқдё“йЎ№иЎҢеҠЁжңүеәҸејҖеұ•пјҢеҺҝеұҖжҲҗз«Ӣжү“еҮ»дҝқеҒҘйЈҹе“ҒвҖңеӣӣйқһвҖҷдё“йЎ№иЎҢеҠЁйўҶеҜје°Ҹз»„пјҢйўҶеҜје°Ҹз»„дёӢи®ҫеҠһе…¬е®ӨеӨ„зҗҶдё“йЎ№иЎҢеҠЁзҡ„ж—ҘеёёдәӢеҠЎпјҢеҗҢж—¶еҲ¶е®ҡе·ҘдҪңж–№жЎҲгҖӮ
пјҲдәҢпјүиҗҪе®һе·ҘдҪңиҙЈд»»гҖӮжӯӨж¬Ўдё“йЎ№иЎҢеҠЁе®һиЎҢеҲҶең°ж®өеҲҶеҚ•дҪҚиҙЈд»»еҲ°дәәгҖӮеҜ№еҸ‘зҺ°зҡ„иҝқжі•иҝқ规иЎҢдёәиҰҒеҸҠж—¶еӨ„зҗҶпјҢиҜҘеӨ„зҪҡзҡ„еҝ…йЎ»еӨ„зҪҡгҖҒиҜҘжӣқе…үзҡ„еҝ…йЎ»жӣқе…үгҖҒиҜҘ移йҖҒе…¬е®үжңәе…ізҡ„еҝ…须移йҖҒгҖӮеҜ№е·ҘдҪңдёҚиҗҪе®һгҖҒзӣ‘зқЈжү§жі•иө°иҝҮеңәд»ҘеҸҠжЎҲ件жҹҘеӨ„дёҚеҠӣзҡ„пјҢе°ҶдҫқзәӘдҫқ规иҝҪ究зӣёе…ідәәе‘ҳиҙЈд»»гҖӮ
пјҲдёүпјүејәеҢ–зӨҫдјҡзӣ‘зқЈгҖӮеҠ ејәиҲҶи®әе®Јдј пјҢиҗҘйҖ иүҜеҘҪж°ӣеӣҙгҖӮжҢүз…§еёӮеұҖж–°й—»е®Јдј е·ҘдҪңзҡ„иҰҒжұӮпјҢдёҘж јжү§иЎҢж–°й—»зәӘеҫӢпјҢ规иҢғдҝЎжҒҜеҸ‘еёғгҖӮдё“йЎ№иЎҢеҠЁжңҹй—ҙпјҢж¶үеҸҠжЎҲ件жҹҘеӨ„жғ…еҶөзҡ„дҝЎжҒҜпјҢз”ұзңҒзә§йЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶйғЁй—Ёз»ҹдёҖеҸ‘еёғпјӣеҗҢж—¶пјҢиҰҒеҸ‘жҢҘ12331е…ЁеӣҪз»ҹдёҖйЈҹе“ҒиҚҜе“ҒжҠ•иҜүдёҫжҠҘз”өиҜқзҡ„дҪңз”ЁпјҢйј“еҠұзӨҫдјҡеҗ„з•ҢйҖҡиҝҮдёҫжҠҘз”өиҜқгҖҒзҪ‘з»ңзӯүеҪўејҸпјҢеҗ‘йЈҹе“ҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶйғЁй—ЁдёҫжҠҘдҝқеҒҘйЈҹе“Ғиҝқжі•иҝқ规иЎҢдёәгҖӮ
пјҲеӣӣпјүеҒҡеҘҪдҝЎжҒҜжҠҘйҖҒгҖӮиҰҒеҸҠж—¶еҗ‘еёӮеұҖжҠҘйҖҒдё“йЎ№иЎҢеҠЁзҡ„е·ҘдҪңиҝӣеұ•гҖҒдё»иҰҒжҲҗж•ҲгҖҒйҮҚеӨ§жЎҲ件е’Ңе·ҘдҪңдёӯйҒҮеҲ°зҡ„йҮҚиҰҒй—®йўҳгҖӮйҷҲжө·еҰӮдәҺ2016е№ҙ6жңҲ9ж—Ҙе’Ң2016е№ҙ9жңҲ22ж—ҘеүҚеҗ‘еёӮеұҖжҠҘйҖҒдё“йЎ№иЎҢеҠЁе…·дҪ“е®һж–Ҫж–№жЎҲе’Ңдё“йЎ№иЎҢеҠЁе·ҘдҪңжҖ»з»“пјҢеңЁдё“йЎ№иЎҢеҠЁжңҹй—ҙпјҢжҜҸжңҲ6ж—ҘеүҚжҠҘйҖҒдёҠжңҲдё“йЎ№иЎҢеҠЁйҳ¶ж®өиҝӣеұ•жғ…еҶөгҖӮеҜ№з¬ҰеҗҲж’Өй”ҖгҖҒжіЁй”ҖдҝқеҒҘйЈҹе“Ғжү№еҮҶиҜҒд№Ұзҡ„пјҢеҸҠж—¶иҝһеҗҢзӣёе…іжқҗж–ҷдёҠжҠҘеёӮеұҖгҖӮ
