2015年镇江市化学中考试卷答案
成考报名 发布时间:09-27 阅读:
2015年镇江市化学中考试卷答案(一)
江苏省镇江市2015年中考化学试题及答案
2015年江苏省镇江市预计于6月17日-19日举行中考,请大家随时关注中国招生考试网,小编将会在镇江中考化学考试结束后第一时间发布江苏省镇江市2015年中考化学试题及答案,以便各位老师和考生下载使用,敬请期待! 另外,小编还将在镇江中考成绩及分数线公布后第一时间在本站发布中考成绩查询入口及分数线,预祝各位考生2015年中考取得好成绩!
中国招生考试网推荐您关注: 2015年镇江中考试题及答案资源专题 或者您可以关注: 2015全国中考试题及答案汇总专题 考后阅读: 2015年镇江市中考成绩查询
2015年镇江市中考分数线
| 镇江市2015年中考各科试卷答案资源 | ||||||||
| 语文 | 数学 | 英语 | 物理 | 生物 | 地理 | 化学 | 政治 | 历史 |
|---|---|---|---|---|---|---|---|---|
|
扫描版 WORD|解析 |
扫描版 WORD|解析 |
扫描版 WORD|解析 |
扫描版 WORD|解析 |
扫描版 WORD|解析 |
扫描版 WORD|解析 |
扫描版 WORD|解析 |
扫描版 WORD|解析 |
扫描版 WORD|解析 |
2015年镇江市化学中考试卷答案(二)
2015年江苏省镇江市中考化学试题(word版 含答案)
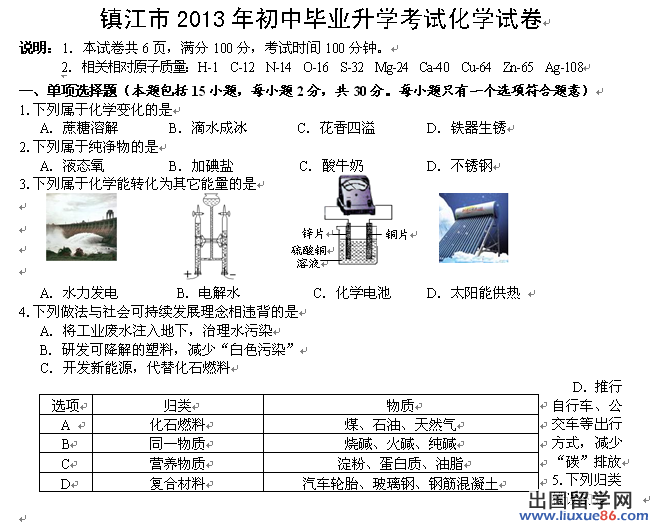
镇江市2015年初中毕业升学考试化学试卷
说明:1.本试卷共6页,满分100分,考试时间100分钟。请将答案填写在答题卷上。
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5
Na-23 K-39 Ca-40 Fe-56 Cu-64 Ba-137
一、单项选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1.下列属于纯净物的是
A.液态氮 B.加碘盐 C.食用醋 D.高钙奶
2.下列属于化学变化的是
A.矿石粉碎 B.冰雪消融 C.石油分馏 D.葡萄酿酒
3.下列物质俗称与化学式相对应的是
A.水银—Ag B.干冰—H2O C.苛性钠—NaOH D.生石灰—Ca(OH)2
4.下列说法错误的是 ..
A.煤气泄漏,应关阀开窗 B.明矾净水,能杀菌消毒
C.煤炭脱硫,可防止酸雨 D.金属回收,使资源再生
5.
6.实验室用KClO3制氧气并回收MnO2和KCl,下列操作不规范的是 .
A.用装置甲收集氧气 B.用装置乙溶解完全反应后的固体
C.用装置丙分离MnO2和KCl溶液 D.用装置丁蒸干分离后的溶液得KCl晶体
7.下列排列顺序正确的是
Cu Fe Al ACO2 N2 O2 B 由少到多 由先到后
NaCl NaOH HCl C.溶液的pH:CuO CuO CuS D.由小到大 由低到高
8.下列实验设计正确的是
A.用托盘天平称取5.62g蔗糖 B.用浓硫酸干燥NH3
C.用KMnO4溶液区分SO2和CO2 D.用活性炭使硬水转化为软水
9.下列对实验现象的描述或实验操作正确的是
A.红磷在空气中燃烧,产生大量白雾
化学试卷 第1页(共6页)
B.点燃或加热可燃性气体前,检验其纯度
C.二氧化碳通入氯化钙溶液中产生白色沉淀
D.稀释浓硫酸时,将水倒入浓硫酸中,并不断搅拌
10.甲和乙可以合成清洁燃料丙,微观过程如下图。下列说法错误的是 ..
A.丁的化学式为H2O2 B.丙中C、H、O的质量比为12:3:8
C.一定浓度的丙溶液可作消毒剂 D.该反应体现无机物可转化为有机物
11.下列指定反应的化学方程式正确的是
A.铁丝在氧气中燃烧:4Fe+3O
2点燃 2Fe2O3
B.铝片溶于稀硫酸:Al+H2SO4AlSO4+ H2↑
C.铜绿的形成:2Cu+O2+H2O+CO2 Cu2(OH)2CO3
D.过氧化钠与二氧化碳反应生成纯碱和氧气:Na2O2+CO2 Na2CO3+O2
12.物质性质决定用途。下列说法错误的是 ..
A.氢氧化钠具有碱性,可用于治疗胃酸过多
B.硫酸铜能使蛋白质变性,可用于游泳池水消毒
C.镁能在空气中燃烧发出耀眼的白光,可用于制造照明弹
D.食醋具有酸性,可用于减轻松花蛋中所含碱性物质的涩味
131423 ① ③ ② 4 3 Na23FeSO4 Fe23 A.①② B.①③C.②③ D.①②③
15.有NaHCO3和Na2CO3的固体混合物13.7g,将其充分加热至固体质量不再减少,得剩余
固体。将产生的气体通入足量的Ca(OH)2溶液中,产生5.0g沉淀。下列说法正确的是
A.剩余固体为混合物
B.剩余固体的质量为11.5g
C.原混合物中Na2CO3的质量大于NaHCO3
D.将剩余固体溶于足量的稀盐酸,产生4.4gCO2
二、不定项选择题(本题包括5小题,每小题2分,共10分。每小题有一个或两个选项符
合题意,错选、多选不给分。若有二个正确选项,只选一个且正确给1分)
化学试卷 第2页(共6页)
16.下列说法正确的是
A.饱和(NH4)2SO4溶液能区分食盐水和蛋白质溶液
B.洗洁精和汽油都能清洗油污,其原理相同
C.饱和溶液转化为不饱和溶液,溶质的质量分数一定减小
D.98.0%的浓硫酸与等体积水混合,得到49.0%的硫酸溶液
17.
A.甲表示NaNO3溶解度曲线
B.40℃时,饱和溶液的溶质质量分数:KNO3>NaNO3 1温度/℃
C.t1应介于60℃~80℃
D.80℃时KNO3饱和溶液中含有少量NaNO3,要得到较纯净的KNO3晶体,可采用降温
结晶、过滤等操作
18.烧杯中盛有BaCl2和HCl的混合溶液100.0g,向其中滴加溶质质量分数为10.0%的Na2CO3
溶液,烧杯中溶液的质量与滴加溶液的质量关系 如右图所示。下列说法正确的是 质量A.ab段产生白色沉淀 B.bc段溶液质量增加86.3g C.c点对应溶液的溶质质量分数为7.5% 23 D.向d点溶液中滴加酚酞试液,溶液显红色 溶液的质量/g
19.下列各组溶液,不用其他试剂就不能鉴别出来的是 ..
A.CuSO4、NaOH、MgCl2、NaCl B.KOH、稀HCl、FeCl3、NaNO3
C.KCl、AgNO3、稀HCl、稀HNO3 D.稀HCl、Na2CO3、BaCl2、Na2SO4
20.右下图为利用燃煤烟气生产Na2SO4和化工原料乙烯(C2H4)的原理。下列说法正确的是
A.副产物M的化学式为HCl B.装置中存在化学能转化为电能的过程 C
2 pH会增大
D.乙烯制备装置中的反应可表示为: HSO 242CO2+2H2O C2H4+3O2 通电 乙烯制备装置 Na2SO4制备装置 三、填空题
(本题包括5小题,共18分)
21.(4分)用化学符号表示:
(1)锌元素 ; (2)2个亚铁离子 ;
(3)五氧化二磷 ; (4)人体缺少 元素会骨质疏松
22.(6分)选择下列适当的物质填空(填字母序号):
A.氢气 B.焦炭 C.金刚石 D.硝酸钾
E.维生素 F.硫酸 G.蛋白质 H.武德合金
化学试卷 第3页(共6页)
(1)理想绿色能源 ; (2)可用作保险丝 ;
(3)自然界硬度最大的是 ; (4)铅蓄电池中的酸 ;
(5)蔬菜、水果中富含 ; (6)复合肥料 。
23.(2分)用石英砂(主要成分SiO2)制造的分离膜 氨水 可以让CO2透过,而其它气体不能透过。CO2通过分离
膜后被氨水吸收转化为氮肥,如右图所示。
(1)SiO2的化学名称为 。 (2)此氮肥的化学式为 。 氮肥
24.(4分)用工业碳酸钙(含有少量Al2O3、Fe2O3)生产医药CaCl2·2H2O的主要流程如下: 2O
阶段一 阶段二
(1)加入试剂A的目的是除去溶液1中少量AlCl3、FeCl3。试剂A可以选择 (选填
序号)。
a.Na2CO3 b.Ba(OH)2 c.Ca(OH)2
(2)阶段一的目的是 。
(3)操作1、2中,所用玻璃仪器有 、玻璃棒、烧杯、胶头滴管。
操作3包括:蒸发浓缩、 、过滤、洗涤等。
25.(2分)金属加工工业排放的废水中含有NaNO2、NaOH,可加入铝粉加热除去。
(1)NaNO2中氮元素的化合价为 。
(2)除去时,生成NaAlO2和能使湿润红色石蕊试纸变蓝的气体,反应的化学方程式为
四、实验题(本题包括2小题,共17分)
26.(10分)请结合图示实验装置,回答下列问题。
(1)写出有标号的仪器名称:① ,② 。
(2)用高锰酸钾制氧气选用的发生装置是 (选填序号),反应的化学方程式为
(3)若B装置中固体为锌粒,②中加入 试剂可制H2。要获得干燥的H2,应先将气
体通过盛有 的D装置,再用E装置收集,气体应从 端通入(选填“a”或“b”)。
(4)实验室可用B或C装置制CO2,反应的化学方程式为 ,C相对于B装置的优
点有 。
(5)若用F装置收集NH3,油层的作用是 。
化学试卷 第4页(共6页)
27.(7分)下图为某同学所做的实验及现象:
(1)实验一中发生两个反应,写出化学方程式 、 。
(2)实验二中出现浅绿色固体。该同学对浅绿色固体的成分作以下探究。
【查阅资料】
①NaOH与CuSO4反应会生成碱式硫酸铜[Cu4(OH)6SO4],其不溶于水,能与酸反应; ②Cu(OH)2分解温度为80℃,Cu4(OH)6SO4分解温度为300℃。
【猜想与假设】
①浅绿色固体为Cu4(OH)6SO4;
②浅绿色固体为Cu4(OH)6SO4和Cu(OH)2的混合物。
【实验验证】
①将实验二的试管加热至100℃,出现黑色固体,则证明浅绿色固体中含有 。 ②从实验二加热后的试管中分离出固体的操作有 、洗涤等。证明固体已洗涤干净的方法是 。
③将②中所得固体溶于足量 (选填序号),再滴加Ba(NO3)2溶液,出现白色沉淀。
A.盐酸 B.稀硝酸 C.稀硫酸
【结论】猜想②正确。
【拓展与思考】 若将实验二中的浅绿色固体浸泡在过量的NaOH溶液中,密封放置一天后,固体全部变为蓝色。写出此反应的化学方程式 。
五、推断题(本题包括2小题,共11分)
28.(5分)有一包不纯的K2CO3粉末,可能含有Na2CO3、BaSO4、CuCl2、KCl、KNO3、Ca(NO3)2
中的一种或几种,为分析含有的杂质,现进行如下实验。
(1)取样溶于水,无固体残留,得无色溶液。则粉末中一定不含有 、 、 。
(2)取上述溶液适量,滴加AgNO3溶液,有白色沉淀,再加入足量稀HNO3,沉淀部分
溶解,则此粉末中一定含有的杂质是 。 (3)为确定Na2CO3是否存在,某同学称取13.8g粉末溶于水,加入足量BaCl2溶液,充分
反应生成19.7g沉淀质量,则原粉末中一定含有Na2CO3。你认为此结论 (选填“是”或“否”)正确。
29.(6分)右下图表示某些物质间转化关系。A、B为组成元素相同的无色液体,D是大理
石的主要成分,C、F、H为气体,且H有刺激性气味。
(1)E的化学式为 。 (2)反应①的化学方程式为 。 (3)反应②的化学方程式为 。 由此反应可知,在农业生产中施用 化学试卷 第
22
2015年镇江市化学中考试卷答案(三)
2015年江苏省镇江市中考化学试卷
2015年江苏省镇江市中考化学试卷
一、单项选择题(本题包括15小题,每小题2分,共30分.每小题只有一个选项符合题意)
1.(2分)(2015•镇江)下列属于纯净物的是( )
A.液态氮 B.加碘盐 C.食用醋 D.高钙奶
2.(2分)(2015•镇江)下列属于化学变化的是( )
A.矿石粉碎 B.冰雪消融 C.石油分馏 D.葡萄酿酒
3.(2分)(2015•镇江)下列物质俗称与化学式相对应的是( )
A.水银﹣Ag B.干冰﹣H2O C.苛性钠﹣NaOH D.生石灰﹣Ca(OH)2
4.(2分)(2015•镇江)下列说法错误的是( )
A.煤气泄漏,应关阀开窗 B.明矾净水,能杀菌消毒
C.煤炭脱硫,可防止酸雨 D.金属回收,使资源再生
)
6.(2分)(2015•镇江)实验室用KClO3制氧气并回收MnO2和KCl,下列操作不规范的是( )
A.用装置甲收集氧气
B.用装置乙溶解完全反应后的固体
C.用装置丙分离MnO2和KCl溶液
D.用装置丁蒸干分离后的溶液得KCl晶体
7.(2分)(2015•镇江)下列排列顺序正确的是( )
A.空气中物质的含量:
B.利用金属的年代:
C.溶液的pH:
D.铜元素的质量分数:
8.(2分)(2015•镇江)下列实验设计正确的是( )
A.用托盘天平称取5.62g蔗糖 B.用浓硫酸干燥NH3
C.用KMnO4溶液区分SO2和CO2 D.用活性炭使硬水转化为软水
9.(2分)(2015•镇江)下列对实验现象的描述或实验操作正确的是( )
A.红磷在空气中燃烧,产生大量白雾
B.点燃或加热可燃性气体前,检验其纯度
C.二氧化碳通入氯化钙溶液中产生白色沉淀
D.稀释浓硫酸时,将水倒入浓硫酸中,并不断搅拌
10.(2分)(2015•镇江)甲和乙可以合成清洁燃料丙,微观过程如图.下列说法错误的是( )
A.丁的化学式为H2O2
B.丙中C、H、O的质量比为12:3:8
C.一定浓度的丙溶液可作消毒剂
D.该反应体现无机物可转化为有机物
11.(2分)(2015•镇江)下列指定反应的化学方程式正确的是( )
A.铁丝在氧气中燃烧:4Fe+3O22Fe2O3
B.铝片溶于稀硫酸:Al+H2SO4═AlSO4+H2↑
C.铜绿的形成:2Cu+O2+H2O+CO2═Cu2(OH)2CO3
D.过氧化钠与二氧化碳反应生成纯碱和氧气:Na2O2+CO2═Na2CO3+O2
12.(2分)(2015•镇江)物质性质决定用途.下列说法错误的是( )
A.氢氧化钠具有碱性,可用于治疗胃酸过多
B.硫酸铜能使蛋白质变性,可用于游泳池水消毒
C.镁能在空气中燃烧发出耀眼的白光,可用于制造照明弹
D.食醋具有酸性,可用于减轻松花蛋中所含碱性物质的涩味
A.A B.B C.C D.D
14.(2分)(2015•镇江)下列各组转化中,一定条件下均能一步实现的组合是( )
A.①②
B.①③ C.②③ D.①②③
15.(2分)(2015•镇江)有NaHCO3和Na2CO3混合物13.7g,将其充分加热至固体质量不再减少,得剩余固体.将产生的气体通入足量的Ca(OH)2溶液中,产生5.0g沉淀.下列说法正确的是( )
A.剩余固体为混合物
B.剩余固体的质量为11.5g
C.原混合物中Na2CO3的质量大于NaHCO3
D.将剩余固体溶于足量的稀盐酸,产生4.4g CO2
二、不定项选择题(本题包括5小题,每小题分,共10分.每小题有一个或两个选项符合题意,错选、多选不给分.若有二个正确选项,只选一个且正确给1分)
16.(2分)(2015•镇江)下列说法正确的是( )
A.饱和(NH4)2SO4溶液能区分食盐水和蛋白质溶液
B.洗洁精和汽油都能清洗油污,其原理相同
C.饱和溶液转化为不饱和溶液,溶质的质量分数一定减小
D.98.0%的浓硫酸与等体积水混合,得到49.0%的硫酸溶液
17.(2分)(2015•镇江)NaNO3和KNO3的溶解度表及溶解度曲线如图.下列说法正确的
A.甲表示NaNO3溶解度曲线
B.40℃时,饱和溶液的溶质质量分数:KNO3>NaNO3
C.t1应介于60℃~80℃
D.80℃时KNO3饱和溶液中含有少量NaNO3,要得到较纯净的KNO3晶体,可采用降温结晶、过滤等操作
18.(2分)(2015•镇江)烧杯中盛有BaCl2和HCl液100.0g,向其中滴加溶质质量分数为10.0%的Na2CO3溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示.下列说法正确的是( )
A.ab段产生白色沉淀
B.bc段溶液质量增加86.3g
C.c点对应溶液的溶质质量分数为7.5%
D.向d点溶液中滴加酚酞试液,溶液显红色
19.(2分)(2015•镇江)下列各组溶液,不用其他试剂就不能鉴别出来的是( )
A.CuSO4、NaOH、MgCl2、NaCl
B.KOH、稀HCl、FeCl3、NaNO3
C.KCl、AgNO3、稀HCl、稀HNO3
D.稀HCl、Na2CO3、BaCl2、Na2SO4
20.(2分)(2015•镇江)如图为利用燃煤烟气生产Na2SO4和化工原料乙烯(C2H4)的原理.下列说法正确的是( )
A.副产物M的化学式为HCl
B.装置中存在化学能转化为电能的过程
C.生产过程中,乙烯制备装置中溶液的pH会增大
D.乙烯制备装置中的反应可表示为:2CO2+2H2O
C2H4+3O2
三、填空题(本题包括5小题,共18分)
21.(4分)(2015•镇江)用化学符号表示:
(1)锌元素 ;
(2)2个亚铁离子 ;
(3)五氧化二磷 ;
(4)人体缺少 元素会骨质疏松.
22.(6分)(2015•镇江)选择下列适当的物质填空(填字母序号):
A.氢气 B.焦炭 C.金刚石 D.硝酸钾
E.维生素 F.硫酸 G.蛋白质 H.武德合金
(1)理想绿色能源 ; (2)可用作保险丝 ;
(3)自然界硬度最大的是 ;(4)铅蓄电池中的酸 ;
(5)蔬菜、水果中富含 ; (6)复合肥料 .
23.(2分)(2015•镇江)用要成分SiO2制造的分离膜可以让CO2透过,而其它气体不能透过.CO2通过分离膜后被氨水吸收转化为氮肥,如图所示.
(1)SiO2的化学名称为 .
(2)此氮肥的化学式为 .
24.(4分)(2015•镇江)用工业碳酸钙(含有少量Al2O3、Fe2O3)生产医药CaCl2•2H2O的主要流程如下:【2015年镇江市化学中考试卷答案】
(1)加入试剂A的目的是除去溶液1中少量AlCl3、FeCl3.试剂A可以选择 (选填序号).
a.Na2CO3 b.Ba(OH)2 c.Ca(OH)2
(2)阶段一的目的是 .
(3)操作1、2中,所用玻璃仪器有 、玻璃棒、烧杯、胶头滴管.操作3包括:蒸发浓缩、 、过滤、洗涤等.
25.(2分)(2015•镇江)金属加工工业排放的废水中含有NaNO2、NaOH,可加入铝粉加热除去.
2015年镇江市化学中考试卷答案(四)
江苏省镇江市2015年中考化学真题试题(含答案)
镇江市2015年初中毕业升学考试化学试卷
说明:1.本试卷共6页,满分100分,考试时间100分钟。请将答案填写在答题卷上。 2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5
Na-23 K-39 Ca-40 Fe-56 Cu-64 Ba-137
一、单项选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意) 1.下列属于纯净物的是
A.液态氮 B.加碘盐 C.食用醋 D.高钙奶 2.下列属于化学变化的是
A.矿石粉碎 B.冰雪消融 C.石油分馏 D.葡萄酿酒 3.下列物质俗称与化学式相对应的是
A.水银—Ag B.干冰—H2O C.苛性钠—NaOH D.生石灰—Ca(OH)2 4.下列说法错误的是 ..A.煤气泄漏,应关阀开窗 B.明矾净水,能杀菌消毒 C.煤炭脱硫,可防止酸雨 D.金属回收,使资源再生 5.
6.实验室用KClO3制氧气并回收MnO2和KCl,下列操作不规范的是 .
A.用装置甲收集氧气 B.用装置乙溶解完全反应后的固体
C.用装置丙分离MnO2和KCl溶液 D.用装置丁蒸干分离后的溶液得KCl晶体 7.下列排列顺序正确的是
CO N O Cu Fe Al
A222B
由少到多 由先到后
NaCl NaOH HCl
C.溶液的pHCuO CuO CuS D.由小到大 由低到高
8.下列实验设计正确的是
A.用托盘天平称取5.62g蔗糖 B.用浓硫酸干燥NH3 C.用KMnO4溶液区分SO2和CO2 D.用活性炭使硬水转化为软水 9.下列对实验现象的描述或实验操作正确的是 A.红磷在空气中燃烧,产生大量白雾 B.点燃或加热可燃性气体前,检验其纯度 C.二氧化碳通入氯化钙溶液中产生白色沉淀
D.稀释浓硫酸时,将水倒入浓硫酸中,并不断搅拌
10.甲和乙可以合成清洁燃料丙,微观过程如下图。下列说法错误的是 ..
A.丁的化学式为H2O2 B.丙中C、H、O的质量比为12:3:8 C.一定浓度的丙溶液可作消毒剂 D.该反应体现无机物可转化为有机物 11.下列指定反应的化学方程式正确的是
点燃
A.铁丝在氧气中燃烧:4Fe+3O22O3 B.铝片溶于稀硫酸:Al+H2SO4
4+ H2↑ C.铜绿的形成:2Cu+O2+H2O+CO22(OH)2CO3
D.过氧化钠与二氧化碳反应生成纯碱和氧气:Na2O2+CO22CO3+O2 12.物质性质决定用途。下列说法错误的是 ..A.氢氧化钠具有碱性,可用于治疗胃酸过多 B.硫酸铜能使蛋白质变性,可用于游泳池水消毒
C.镁能在空气中燃烧发出耀眼的白光,可用于制造照明弹 D.食醋具有酸性,可用于减轻松花蛋中所含碱性物质的涩味 14.下列各组转化中,一定条件下均能一步实现的组合是
23
① ③ ② 3 Na2CO3CuSO4 FeSO4 Fe2O
3
A.①② B.①③ C.②③ D.①②③
15.有NaHCO3和Na2CO3的固体混合物13.7g,将其充分加热至固体质量不再减少,得剩余固体。将产生的气体通入足量的Ca(OH)2溶液中,产生5.0g沉淀。下列说法正确的是 A.剩余固体为混合物
B.剩余固体的质量为11.5g
C.原混合物中Na2CO3的质量大于NaHCO3
D.将剩余固体溶于足量的稀盐酸,产生4.4gCO2 二、不定项选择题(本题包括5小题,每小题2分,共10分。每小题有一个或两个选项符合题意,错选、多选不给分。若有二个正确选项,只选一个且正确给1分) 16.下列说法正确的是
A.饱和(NH4)2SO4溶液能区分食盐水和蛋白质溶液 B.洗洁精和汽油都能清洗油污,其原理相同
C.饱和溶液转化为不饱和溶液,溶质的质量分数一定减小 D.98.0%的浓硫酸与等体积水混合,得到49.0%的硫酸溶液 17.NaNO3和KNO3的溶解度表及溶解度曲线如下。下列说法正确的是
甲
溶 解 度/g
乙
A.甲表示NaNO3溶解度曲线
B.40℃时,饱和溶液的溶质质量分数:KNO3>NaNO3 0 t1 温度/℃ C.t1应介于60℃~80℃
D.80℃时KNO3饱和溶液中含有少量NaNO3,要得到较纯净的KNO3晶体,可采用降温结晶、过滤
等操作
18.烧杯中盛有BaCl2和HCl的混合溶液100.0g,向其中滴加溶质质量分数为10.0%的Na2CO3溶液,烧杯中溶液的质量与滴加溶液的质量关系 如右图所示。下列说法正确的是 质量A.ab段产生白色沉淀 B.bc段溶液质量增加86.3g
C.c点对应溶液的溶质质量分数为7.5%
23
0 D.向d点溶液中滴加酚酞试液,溶液显红色 溶液的质量/g
19.下列各组溶液,不用其他试剂就不能鉴别出来的是 ..A.CuSO4、NaOH、MgCl2、NaCl B.KOH、稀HCl、FeCl3、NaNO3 C.KCl、AgNO3、稀HCl、稀HNO3 D.稀HCl、Na2CO3、BaCl2、Na2SO4
20.右下图为利用燃煤烟气生产Na2SO4和化工原料乙烯(C2H4)的原理。下列说法正确的是
A.副产物M的化学式为HCl
B.装置中存在化学能转化为电能的过程 C.生产过程中,乙烯制备装置中溶液的
pH会增大 2 D.乙烯制备装置中的反应可表示为:
2CO2+2H2H4+3O2 通电
Na2SO4制备装置 乙烯制备装置
三、填空题(本题包括5小题,共18分) 21.(4分)用化学符号表示:
(1)锌元素 ▲ ; (2)2个亚铁离子 ▲ ;
(3)五氧化二磷 ▲ ; (4)人体缺少 ▲ 元素会骨质疏松 22.(6分)选择下列适当的物质填空(填字母序号):
A.氢气 B.焦炭 C.金刚石 D.硝酸钾 E.维生素 F.硫酸 G.蛋白质 H.武德合金
(1)理想绿色能源 ▲ ; (2)可用作保险丝 ▲ ; (3)自然界硬度最大的是 ▲ ; (4)铅蓄电池中的酸 ▲ ; (5)蔬菜、水果中富含 ▲ ; (6)复合肥料 ▲ 。
23.(2分)用石英砂(主要成分SiO2)制造的分离膜可以让CO2透过,而其它气体不能透过。CO2通
过分离膜后被氨水吸收转化为氮肥,如右下图所示。
(1)SiO2的化学名称为 ▲ 。
(2)此氮肥的化学式为 ▲ 。 氮肥
24.(4分)用工业碳酸钙(含有少量Al2O3、Fe2O3)生产医药CaCl2·2H2O的主要流程如下:
2O
阶段一 阶段二
(1)加入试剂A的目的是除去溶液1中少量AlCl3、FeCl3。试剂A可以选择 ▲ (选填序号)。
a.Na2CO3 b.Ba(OH)2 c.Ca(OH)2
(2)阶段一的目的是 ▲ 。
(3)操作1、2中,所用玻璃仪器有 ▲ 、玻璃棒、烧杯、胶头滴管。
操作3包括:蒸发浓缩、 ▲ 、过滤、洗涤等。
25.(2分)金属加工工业排放的废水中含有NaNO2、NaOH,可加入铝粉加热除去。 (1)NaNO2中氮元素的化合价为 ▲ 。
(2)除去时,生成NaAlO2和能使湿润红色石蕊试纸变蓝的气体,反应的化学方程式为
▲ 。
四、实验题(本题包括2小题,共17分)
26.(10分)请结合图示实验装置,回答下列问题。
(1)写出有标号的仪器名称:① ▲ ,② ▲ 。
(2)用高锰酸钾制氧气选用的发生装置是 ▲ (选填序号),反应的化学方程式为
▲ 。
(3)若B装置中固体为锌粒,②中加入 ▲ 试剂可制H2。要获得干燥的H2,应先将气体通过
盛有 ▲ 的D装置,再用E装置收集,气体应从 ▲ 端通入(选填“a”或“b”)。 (4)实验室可用B或C装置制CO2,反应的化学方程式为 ▲ ,C相对于B装置的优点有
▲ 。
(5)若用F装置收集NH3,油层的作用是 ▲ 。 27.(7分)下图为某同学所做的实验及现象:
(1)实验一中发生两个反应,写出化学方程式 ▲ 、 ▲ 。 (2)实验二中出现浅绿色固体。该同学对浅绿色固体的成分作以下探究。 【查阅资料】
①NaOH与CuSO4反应会生成碱式硫酸铜[Cu4(OH)6SO4],其不溶于水,能与酸反应; ②Cu(OH)2分解温度为80℃,Cu4(OH)6SO4分解温度为300℃。 【猜想与假设】
①浅绿色固体为Cu4(OH)6SO4;
②浅绿色固体为Cu4(OH)6SO4和Cu(OH)2的混合物。 【实验验证】
①将实验二的试管加热至100℃,出现黑色固体,则证明浅绿色固体中含有 ▲ 。
②从实验二加热后的试管中分离出固体的操作有 ▲ 、洗涤等。证明固体已洗涤干净的方法是 ▲ 。
③将②中所得固体溶于足量 ▲ (选填序号),再滴加Ba(NO3)2溶液,出现白色沉淀。
A.盐酸 B.稀硝酸 C.稀硫酸
【结论】猜想②正确。 【拓展与思考】
若将实验二中的浅绿色固体浸泡在过量的NaOH溶液中,密封放置一天后,固体全部变为蓝色。写出此反应的化学方程式 ▲ 。
五、推断题(本题包括2小题,共11分)
28.(5分)有一包不纯的K2CO3粉末,可能含有Na2CO3、BaSO4、CuCl2、KCl、KNO3、Ca(NO3)2中的一种或几种,为分析含有的杂质,现进行如下实验。
(1)取样溶于水,无固体残留,得无色溶液。则粉末中一定不含有 ▲ 、 ▲ 、 ▲ 。
(2)取上述溶液适量,滴加AgNO3溶液,有白色沉淀,再加入足量稀HNO3,沉淀部分溶解,则此
粉末中一定含有的杂质是 ▲ 。
(3)为确定Na2CO3是否存在,某同学称取13.8g粉末溶于水,加入足量BaCl2溶液,充分反应生
成19.7g沉淀质量,则原粉末中一定含有Na2CO3。你认为此结论 ▲ (选填“是”或“否”)正确。
29.(6分)右下图表示某些物质间转化关系。A、B为组成元素相同的无色液体,D是大理石的主要成分,C、F、H为气体,且H有刺激性气味。 (1)E的化学式为 ▲ 。 (2)反应①的化学方程式为 ▲ 。
(3)反应②的化学方程式为 ▲ 。
由此反应可知,在农业生产中施用 铵态氮肥时应注意 ▲ 。 (4)自然界中普遍存在着F转化为C的
22反应,名称为 ▲ ;工业生产中
用F和H合成尿素,反应中F和H的质量比为 ▲ 。
六、综合题(本题包括1小题,共14分)
30.(14分)目前,我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础。 (一)铁的广泛应用
1.我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理 ▲ 。 2.铁与铬(Cr)、镍(Ni)等金属熔合可形成“不锈钢”,用不锈钢丝和聚乙烯纤维为 原料可制作耐酸防护服材料。以上叙述中不涉及到 ▲ (选填序号)。 A.合金 B.无机非金属材料 C.合成材料 D.复合材料
3.某品牌的麦片中含微量铁粉,食用后可在胃酸的作用下转化为人体可吸收的铁元素,反应的
化学方程式为 ▲ 。 (二)铁锈成分的探究
1.右图为某兴趣小组探究铁生锈的三个实验,
NaCl 最先观察到铁锈的是 ▲ (选填序号)。 水
溶液
A B C
O、HO2、CO2、H2O
O2、H2O
2015年镇江市化学中考试卷答案(五)
江苏省镇江市2015年中考化学试题(word版,含答案)
镇江市2015年初中毕业升学考试化学试卷 说明:1.本试卷共6页,满分100分,考试时间100分钟。请将答案填写在答题卷上。
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5
Na-23 K-39 Ca-40 Fe-56 Cu-64 Ba-137
一、单项选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1.下列属于纯净物的是
A.液态氮 B.加碘盐 C.食用醋 D.高钙奶
2.下列属于化学变化的是
A.矿石粉碎 B.冰雪消融 C.石油分馏 D.葡萄酿酒
3.下列物质俗称与化学式相对应的是
A.水银—Ag B.干冰—H2O C.苛性钠—NaOH D.生石灰—Ca(OH)2
4.下列说法错误的是 ..
A.煤气泄漏,应关阀开窗 B.明矾净水,能杀菌消毒
C.煤炭脱硫,可防止酸雨 D.金属回收,使资源再生
5.
6.实验室用KClO3制氧气并回收MnO2和KCl,下列操作不规范的是 .
A.用装置甲收集氧气 B.用装置乙溶解完全反应后的固体
C.用装置丙分离MnO2和KCl溶液 D.用装置丁蒸干分离后的溶液得KCl晶体
7.下列排列顺序正确的是
Cu Fe Al ACO2 N2 O2 B 由少到多 由先到后
NaCl NaOH HCl C.溶液的pH:CuO CuO CuS D.由小到大 由低到高
8.下列实验设计正确的是
A.用托盘天平称取5.62g蔗糖 B.用浓硫酸干燥NH3
C.用KMnO4溶液区分SO2和CO2 D.用活性炭使硬水转化为软水 1
化学试卷 第页(共6页)
9.下列对实验现象的描述或实验操作正确的是
A.红磷在空气中燃烧,产生大量白雾
B.点燃或加热可燃性气体前,检验其纯度
C.二氧化碳通入氯化钙溶液中产生白色沉淀
D.稀释浓硫酸时,将水倒入浓硫酸中,并不断搅拌
10.甲和乙可以合成清洁燃料丙,微观过程如下图。下列说法错误的是 ..
A.丁的化学式为H2O2 B.丙中C、H、O的质量比为12:3:8
C.一定浓度的丙溶液可作消毒剂 D.该反应体现无机物可转化为有机物
11.下列指定反应的化学方程式正确的是
点燃 A.铁丝在氧气中燃烧:4Fe+3O22Fe2O3
B.铝片溶于稀硫酸:Al+H2SO
4AlSO4+ H2↑ C.铜绿的形成:2Cu+O2+H2O+CO2 Cu2(OH)2CO3
D.过氧化钠与二氧化碳反应生成纯碱和氧气:Na2O2+CO2 Na2CO3+O2
12.物质性质决定用途。下列说法错误的是 ..
A.氢氧化钠具有碱性,可用于治疗胃酸过多
B.硫酸铜能使蛋白质变性,可用于游泳池水消毒
C.镁能在空气中燃烧发出耀眼的白光,可用于制造照明弹【2015年镇江市化学中考试卷答案】
D.食醋具有酸性,可用于减轻松花蛋中所含碱性物质的涩味
1314.下列各组转化中,一定条件下均能一步实现的组合是
23 ① ③ ② 4 3 NaCO23FeSO4 Fe23 A.①② B.①③C.②③ D.①②③
15.有NaHCO3和Na2CO3的固体混合物13.7g,将其充分加热至固体质量不再减少,得剩余固体。将产生的气体通入足量的Ca(OH)2溶液中,产生5.0g沉淀。下列说法正确的是
A.剩余固体为混合物
B.剩余固体的质量为11.5g
C.原混合物中Na2CO3的质量大于NaHCO3
2
化学试卷 第页(共6页)
D.将剩余固体溶于足量的稀盐酸,产生4.4gCO2
二、不定项选择题(本题包括5小题,每小题2分,共10分。每小题有一个或两个选项符
合题意,错选、多选不给分。若有二个正确选项,只选一个且正确给1分)
16.下列说法正确的是
A.饱和(NH4)2SO4溶液能区分食盐水和蛋白质溶液
B.洗洁精和汽油都能清洗油污,其原理相同
C.饱和溶液转化为不饱和溶液,溶质的质量分数一定减小【2015年镇江市化学中考试卷答案】
D.98.0%的浓硫酸与等体积水混合,得到49.0%的硫酸溶液
17.
溶 解 度/g 乙 3B.40℃时,饱和溶液的溶质质量分数:KNO3>NaNO3 0 t1 温度/℃ C.t1应介于60℃~80℃
D.80℃时KNO3饱和溶液中含有少量NaNO3,要得到较纯净的KNO3晶体,可采用降温
结晶、过滤等操作
18.烧杯中盛有BaCl2和HCl的混合溶液100.0g,向其中滴加溶质质量分数为10.0%的Na2CO3溶液,烧杯中溶液的质量与滴加溶液的质量关系 如右图所示。下列说法正确的是 质量A.ab段产生白色沉淀 B.bc段溶液质量增加86.3g C.c点对应溶液的溶质质量分数为7.5% 23 D.向d点溶液中滴加酚酞试液,溶液显红色 溶液的质量/g
19.下列各组溶液,不用其他试剂就不能鉴别出来的是 ..
A.CuSO4、NaOH、MgCl2、NaCl B.KOH、稀HCl、FeCl3、NaNO3
C.KCl、AgNO3、稀HCl、稀HNO3 D.稀HCl、Na2CO3、BaCl2、Na2SO4
20.右下图为利用燃煤烟气生产Na2SO4和化工原料乙烯(C2H4)的原理。下列说法正确的是
A.副产物M的化学式为HCl B.装置中存在化学能转化为电能的过程 C
2 pH会增大
D.乙烯制备装置中的反应可表示为: 2CO2+2H2O H2SO4 C2H4+3O2 通电 Na2SO4制备装置 乙烯制备装置 三、填空题(本题包括5小题,共18分)
21.(4分)用化学符号表示:
(1)锌元素 ▲ ; (2)2个亚铁离子 ▲ ;
(3)五氧化二磷 ▲ ; (4)人体缺少 ▲ 元素会骨质疏松
3
化学试卷 第页(共6页)
22.(6分)选择下列适当的物质填空(填字母序号):
A.氢气 B.焦炭 C.金刚石 D.硝酸钾
E.维生素 F.硫酸 G.蛋白质 H.武德合金
(1)理想绿色能源 ▲ ; (2)可用作保险丝 ▲ ;
(3)自然界硬度最大的是 ▲ ; (4)铅蓄电池中的酸 ▲ ;
(5)蔬菜、水果中富含 ▲ ; (6)复合肥料 ▲ 。
23.(2分)用石英砂(主要成分SiO2)制造的分离膜可以让CO2透过,而其它气体不能透
过。CO2
(1)SiO2的化学名称为 ▲ 。
(2)此氮肥的化学式为 ▲ 。 氮肥
24.(4分)用工业碳酸钙(含有少量Al2O3、Fe2O3)生产医药CaCl2·2H2O的主要流程如下: 2O
阶段一 阶段二
(1)加入试剂A的目的是除去溶液1中少量AlCl3、FeCl3。试剂A可以选择 ▲ (选
填序号)。
a.Na2CO3 b.Ba(OH)2 c.Ca(OH)2
(2)阶段一的目的是 ▲ 。
(3)操作1、2中,所用玻璃仪器有 ▲ 、玻璃棒、烧杯、胶头滴管。
操作3包括:蒸发浓缩、 ▲ 、过滤、洗涤等。
25.(2分)金属加工工业排放的废水中含有NaNO2、NaOH,可加入铝粉加热除去。
(1)NaNO2中氮元素的化合价为 ▲ 。
(2)除去时,生成NaAlO2和能使湿润红色石蕊试纸变蓝的气体,反应的化学方程式为
。
四、实验题(本题包括2小题,共17分)
26.(10分)请结合图示实验装置,回答下列问题。
(1)写出有标号的仪器名称:① ▲ ,② ▲ 。
(2)用高锰酸钾制氧气选用的发生装置是 ▲ (选填序号),反应的化学方程式为
。
(3)若B装置中固体为锌粒,②中加入 ▲ 试剂可制H2。要获得干燥的H2,应先将
气体通过盛有 ▲ 的D装置,再用E装置收集,气体应从 ▲ 端通入(选填“a”或“b”)。
4 化学试卷 第页(共6页)
(4)实验室可用B或C装置制CO2,反应的化学方程式为 ▲ ,C相对于B装置的
优点有 ▲ 。
(5)若用F装置收集NH3,油层的作用是 ▲ 。
27.(7分)下图为某同学所做的实验及现象:
(1)实验一中发生两个反应,写出化学方程式 ▲ 、 ▲ 。
(2)实验二中出现浅绿色固体。该同学对浅绿色固体的成分作以下探究。
【查阅资料】
①NaOH与CuSO4反应会生成碱式硫酸铜[Cu4(OH)6SO4],其不溶于水,能与酸反应; ②Cu(OH)2分解温度为80℃,Cu4(OH)6SO4分解温度为300℃。
【猜想与假设】
①浅绿色固体为Cu4(OH)6SO4;
②浅绿色固体为Cu4(OH)6SO4和Cu(OH)2的混合物。
【实验验证】
①将实验二的试管加热至100℃,出现黑色固体,则证明浅绿色固体中含有 ▲ 。 ②从实验二加热后的试管中分离出固体的操作有 ▲ 、洗涤等。证明固体已洗涤干净的方法是 ▲ 。
③将②中所得固体溶于足量 ▲ (选填序号),再滴加Ba(NO3)2溶液,出现白色沉淀。
A.盐酸 B.稀硝酸 C.稀硫酸
【结论】猜想②正确。
【拓展与思考】
若将实验二中的浅绿色固体浸泡在过量的NaOH溶液中,密封放置一天后,固体全部变为蓝色。写出此反应的化学方程式 ▲ 。
五、推断题(本题包括2小题,共11分)
28.(5分)有一包不纯的K2CO3粉末,可能含有Na2CO3、BaSO4、CuCl2、KCl、KNO3、Ca(NO3)2中的一种或几种,为分析含有的杂质,现进行如下实验。
(1)取样溶于水,无固体残留,得无色溶液。则粉末中一定不含有 ▲ 、 ▲ 、 ▲ 。
(2)取上述溶液适量,滴加AgNO3溶液,有白色沉淀,再加入足量稀HNO3,沉淀部分
溶解,则此粉末中一定含有的杂质是 ▲ 。
(3)为确定Na2CO3是否存在,某同学称取13.8g粉末溶于水,加入足量BaCl2溶液,充分
反应生成19.7g沉淀质量,则原粉末中一定含有Na2CO3。你认为此结论 ▲ (选填“是”或“否”)正确。
29.(6分)右下图表示某些物质间转化关系。A、B为组成元素相同的无色液体,D是大理5
化学试卷 第页(共6页)
2015年镇江市化学中考试卷答案(六)
江苏省镇江市2015年化学中考真题
镇江市2015年初中毕业升学考试化学试卷
说明:1.本试卷共6页,满分100分,考试时间100分钟。请将答案填写在答题卷上。 2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5
Na-23 K-39 Ca-40 Fe-56 Cu-64 Ba-137
一、单项选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意) 1.下列属于纯净物的是
A.液态氮 B.加碘盐 C.食用醋 D.高钙奶 2.下列属于化学变化的是
A.矿石粉碎 B.冰雪消融 C.石油分馏 D.葡萄酿酒 3.下列物质俗称与化学式相对应的是
A.水银—Ag B.干冰—H2O C.苛性钠—NaOH D.生石灰—Ca(OH)2 4.下列说法错误的是 ..A.煤气泄漏,应关阀开窗 B.明矾净水,能杀菌消毒 C.煤炭脱硫,可防止酸雨 D.金属回收,使资源再生 5.
6.实验室用KClO3制氧气并回收MnO2和KCl,下列操作不规范的是 .
A.用装置甲收集氧气 B.用装置乙溶解完全反应后的固体
C.用装置丙分离MnO2和KCl溶液 D.用装置丁蒸干分离后的溶液得KCl晶体 7.下列排列顺序正确的是
Cu Fe Al ACO2 N2 O2 B
由少到多 由先到后
NaCl NaOH HCl
C.溶液的pHCuO CuO CuS D.由小到大 由低到高
8.下列实验设计正确的是
A.用托盘天平称取5.62g蔗糖 B.用浓硫酸干燥NH3
C.用KMnO4溶液区分SO2和CO2 D.用活性炭使硬水转化为软水 9.下列对实验现象的描述或实验操作正确的是 A.红磷在空气中燃烧,产生大量白雾 B.点燃或加热可燃性气体前,检验其纯度 C.二氧化碳通入氯化钙溶液中产生白色沉淀
D.稀释浓硫酸时,将水倒入浓硫酸中,并不断搅拌
10.甲和乙可以合成清洁燃料丙,微观过程如下图。下列说法错误的是 ..
A.丁的化学式为H2O2 B.丙中C、H、O的质量比为12:3:8 C.一定浓度的丙溶液可作消毒剂 D.该反应体现无机物可转化为有机物 11.下列指定反应的化学方程式正确的是 A.铁丝在氧气中燃烧:4Fe+3O
2点燃 2Fe2O3 B.铝片溶于稀硫酸:Al+H2SO4 AlSO4+ H2↑
C.铜绿的形成:2Cu+O2+H2O+CO2 Cu2(OH)2CO3
D.过氧化钠与二氧化碳反应生成纯碱和氧气:Na2O2+CO2 Na2CO3+O2 12.物质性质决定用途。下列说法错误的是 ..A.氢氧化钠具有碱性,可用于治疗胃酸过多 B.硫酸铜能使蛋白质变性,可用于游泳池水消毒
C.镁能在空气中燃烧发出耀眼的白光,可用于制造照明弹 D.食醋具有酸性,可用于减轻松花蛋中所含碱性物质的涩味 1314.下列各组转化中,一定条件下均能一步实现的组合是
23
① ③ ② 4 3 Na2CO3FeSO4 Fe23
A.①② B.①③C.②③ D.①②③
15.有NaHCO3和Na2CO3的固体混合物13.7g,将其充分加热至固体质量不再减少,得剩余固体。将产生的气体通入足量的Ca(OH)2溶液中,产生5.0g沉淀。下列说法正确的是 A.剩余固体为混合物
B.剩余固体的质量为11.5g
C.原混合物中Na2CO3的质量大于NaHCO3
D.将剩余固体溶于足量的稀盐酸,产生4.4gCO2
二、不定项选择题(本题包括5小题,每小题2分,共10分。每小题有一个或两个选项符合题意,错选、
多选不给分。若有二个正确选项,只选一个且正确给1分) 16.下列说法正确的是
A.饱和(NH4)2SO4溶液能区分食盐水和蛋白质溶液 B.洗洁精和汽油都能清洗油污,其原理相同
C.饱和溶液转化为不饱和溶液,溶质的质量分数一定减小 D.98.0%的浓硫酸与等体积水混合,得到49.0%的硫酸溶液

17.
溶 解 度/g

乙
3B.40℃时,饱和溶液的溶质质量分数:KNO3>NaNO3
0 t1 温度/℃
C.t1应介于60℃~80℃
D.80℃时KNO3饱和溶液中含有少量NaNO3,要得到较纯净的KNO3晶体,可采用降温结晶、过滤等
操作
18.烧杯中盛有BaCl2和HCl的混合溶液100.0g,向其中滴加溶质质量分数为10.0%的Na2CO3溶液,烧杯中溶液的质量与滴加溶液的质量关系
如右图所示。下列说法正确的是 质量A.ab段产生白色沉淀 B.bc段溶液质量增加86.3g
C.c点对应溶液的溶质质量分数为7.5%
23 0 D.向d点溶液中滴加酚酞试液,溶液显红色 溶液的质量/g
19.下列各组溶液,不用其他试剂就不能鉴别出来的是 ..A.CuSO4、NaOH、MgCl2、NaCl B.KOH、稀HCl、FeCl3、NaNO3 C.KCl、AgNO3、稀HCl、稀HNO3 D.稀HCl、Na2CO3、BaCl2、Na2SO4 20.右下图为利用燃煤烟气生产Na2SO4和化工原料乙烯(C2H4)的原理。下列说法正确的是
A.副产物M的化学式为HCl
B.装置中存在化学能转化为电能的过程
C
2 pH会增大
D.乙烯制备装置中的反应可表示为:
2CO2+2H2O H2SO4 C2H4+3O2 通电
Na2SO4制备装置 乙烯制备装置 三、填空题(本题包括5小题,共18分)
21.(4分)用化学符号表示:
(1)锌元素 ▲ ; (2)2个亚铁离子 ▲ ;
(3)五氧化二磷 ▲ ; (4)人体缺少 ▲ 元素会骨质疏松 22.(6分)选择下列适当的物质填空(填字母序号):
A.氢气 B.焦炭 C.金刚石 D.硝酸钾 E.维生素 F.硫酸 G.蛋白质 H.武德合金
(1)理想绿色能源 ▲ ; (2)可用作保险丝 ▲ ; (3)自然界硬度最大的是 ▲ ; (4)铅蓄电池中的酸 ▲ ; (5)蔬菜、水果中富含 ▲ ; (6)复合肥料 ▲ 。
23.(2分)用石英砂(主要成分SiO2)制造的分离膜可以让CO2透过,而其它气体不能透过。CO2通过
分离膜后被氨水吸收转化为氮肥,如右下图所示。
(1)SiO2的化学名称为 ▲ 。
(2)此氮肥的化学式为 ▲ 。 氮肥
24.(4分)用工业碳酸钙(含有少量Al2O3、Fe2O3)生产医药CaCl2·2H2O的主要流程如下:
2O
阶段一 阶段二
(1)加入试剂A的目的是除去溶液1中少量AlCl3、FeCl3。试剂A可以选择 ▲ (选填序号)。
a.Na2CO3 b.Ba(OH)2 c.Ca(OH)2
(2)阶段一的目的是 ▲ 。
(3)操作1、2中,所用玻璃仪器有 ▲ 、玻璃棒、烧杯、胶头滴管。
操作3包括:蒸发浓缩、 ▲ 、过滤、洗涤等。
25.(2分)金属加工工业排放的废水中含有NaNO2、NaOH,可加入铝粉加热除去。 (1)NaNO2中氮元素的化合价为 ▲ 。
(2)除去时,生成NaAlO2和能使湿润红色石蕊试纸变蓝的气体,反应的化学方程式为
四、实验题(本题包括2小题,共17分)
26.(10分)请结合图示实验装置,回答下列问题。
(1)写出有标号的仪器名称:① ▲ ,② ▲ 。 (2)用高锰酸钾制氧气选用的发生装置是 ▲ (选填序号),反应的化学方程式为
(3)若B装置中固体为锌粒,②中加入 ▲ 试剂可制H2。要获得干燥的H2,应先将气体通过盛有 ▲
的D装置,再用E装置收集,气体应从 ▲ 端通入(选填“a”或“b”)。
(4)实验室可用B或C装置制CO2,反应的化学方程式为 ▲ ,C相对于B装置的优点有
。
(5)若用F装置收集NH3,油层的作用是 ▲ 。 27.(7分)下图为某同学所做的实验及现象:
(1)实验一中发生两个反应,写出化学方程式 ▲ 、 ▲ 。 (2)实验二中出现浅绿色固体。该同学对浅绿色固体的成分作以下探究。 【查阅资料】
①NaOH与CuSO4反应会生成碱式硫酸铜[Cu4(OH)6SO4],其不溶于水,能与酸反应; ②Cu(OH)2分解温度为80℃,Cu4(OH)6SO4分解温度为300℃。
【猜想与假设】
①浅绿色固体为Cu4(OH)6SO4;
②浅绿色固体为Cu4(OH)6SO4和Cu(OH)2的混合物。 【实验验证】
①将实验二的试管加热至100℃,出现黑色固体,则证明浅绿色固体中含有 ▲ 。
②从实验二加热后的试管中分离出固体的操作有 ▲ 、洗涤等。证明固体已洗涤干净的方法是
③将②中所得固体溶于足量 ▲ (选填序号),再滴加Ba(NO3)2溶液,出现白色沉淀。
A.盐酸 B.稀硝酸 C.稀硫酸
【结论】猜想②正确。 【拓展与思考】
若将实验二中的浅绿色固体浸泡在过量的NaOH溶液中,密封放置一天后,固体全部变为蓝色。写出此反应的化学方程式 ▲ 。
五、推断题(本题包括2小题,共11分) 28.(5分)有一包不纯的K2CO3粉末,可能含有Na2CO3、BaSO4、CuCl2、KCl、KNO3、Ca(NO3)2中的一种或几种,为分析含有的杂质,现进行如下实验。
(1)取样溶于水,无固体残留,得无色溶液。则粉末中一定不含有 ▲ 、 ▲ 、 ▲ 。
(2)取上述溶液适量,滴加AgNO3溶液,有白色沉淀,再加入足量稀HNO3,沉淀部分溶解,则此粉
末中一定含有的杂质是 ▲ 。
(3)为确定Na2CO3是否存在,某同学称取13.8g粉末溶于水,加入足量BaCl2溶液,充分反应生成19.7g
沉淀质量,则原粉末中一定含有Na2CO3。你认为此结论 ▲ (选填“是”或“否”)正确。
29.(6分)右下图表示某些物质间转化关系。A、B为组成元素相同的无色液体,D是大理石的主要成分,C、F、H为气体,且H有刺激性气味。 (1)E的化学式为 ▲ 。 (2)反应①的化学方程式为 ▲ 。
(3)反应②的化学方程式为 ▲ 。 由此反应可知,在农业生产中施用 铵态氮肥时应注意 ▲ 。 (4)自然界中普遍存在着F转化为C的
22反应,名称为 ▲ ;工业生产中
用F和H合成尿素,反应中F和H的质量比为 ▲ 。
六、综合题(本题包括1小题,共14分) 30.(14分)目前,我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础。 (一)铁的广泛应用
1.我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理。 2.铁与铬(Cr)、镍(Ni)等金属熔合可形成“不锈钢”,用不锈钢丝和聚乙烯纤维为 原料可制作耐酸防护服材料。以上叙述中不涉及到 ▲ (选填序号)。 A.合金 B.无机非金属材料 C.合成材料 D.复合材料 3.某品牌的麦片中含微量铁粉,食用后可在胃酸的作用下转化为人体可吸收的铁元素,反应的化学方
程式为 ▲ 。 (二)铁锈成分的探究
1.右图为某兴趣小组探究铁生锈的三个实验,
NaCl 最先观察到铁锈的是 ▲ (选填序号)。 水
溶液
A B C
O、HO2、CO2、H2O
O、HO
风吹日晒
